摘 要: 目的 研究逆萎康对胃癌前病变细胞 (MC细胞) 凋亡的影响及其可能的作用机制。方法 用不同浓度的逆萎康汤剂分别作用于MC细胞, 采用流式细胞仪分别检测细胞的凋亡情况;采用实时荧光定量PCR (RTqPCR) 技术检测细胞中c-myc基因、细胞周期素D1 (cyclin D1) 基因的表达;采用免疫印迹法 (Western Blot) 检测细胞中B淋巴细胞瘤-2 (Bcl-2) 、Bcl-2相关X蛋白 (Bax) 、半胱氨酸蛋白酶-3 (Caspase-3) 、β-连环蛋白 (β-catenin) 、10号染色体上缺失的磷酸酶和紧张素同系物 (PTEN) 、糖原合成酶激酶3β (GSK-3β) 和磷酸化糖原合成酶激酶3β (pGSK-3β) 蛋白的表达量。结果 随着逆萎康汤剂浓度的增加, 其促MC细胞凋亡的作用逐渐增强 (F=24.864, P<0.05) 。逆萎康作用48h后, 可以降低MC细胞中c-myc、cyclin D1基因的表达 (F=113.404、275.962, P<0.05) 。逆萎康作用48h后, MC细胞中Bcl-2、β-catenin、p-GSK-3β蛋白的表达明显降低 (F=14.783~74.654, P<0.05) , Bax、Caspase-3、PTEN蛋白的表达明显增加 (F=15.408~63.224, P<0.05) , GSK-3β蛋白的表达无显着改变 (P>0.05) 。结论 逆萎康能有效地促使MC细胞凋亡, 其机制可能与抑制Wnt/β-catenin信号通路的激活有关。
关键词: 逆萎康; 胃肿瘤; 癌前状态; 细胞凋亡; Wnt信号通路;
Abstract: Objective To study the effect of Niweikang on the apoptosis of precancerous lesions of gastric cancer (MC cells) and its possible mechanism of action. Methods MC cells were treated with different concentrations of Niweikang, and a flow cytometer was used to determine cell apoptosis;quantitative real-time PCR was used to determine the mRNA expression of c-myc and cyclin D1 in the cells;Western Blot was used to determine the protein expression of B-cell lymphoma-2 (Bcl-2) , Bcl-2-associated X protein (Bax) , Caspase-3, β-catenin, phosphatase and tensin homolog deleted on chromosome 10 (PTEN) , glycogen synthase kinase-3β (GSK-3β) , and phosphorylated glycogen synthase kinase-3β (p-GSK-3β) . Results Niweikang showed a gradually enhanced apoptosis-promoting effect on MC cells as its concentration increased (F=24.864, P<0.05) .After 48 htreatment with Niweikang, the mRNA expression of c-myc and cyclin D1 in MC cells was significantly reduced (F=113.404, 275.962, respectively, P<0.05) ;meanwhile, the protein expression of Bcl-2, β-catenin, and p-GSK-3βin MC cells was significantly reduced (F=14.783-74.654, P <0.05) , but the protein expression of Bax, Caspase-3, and PTEN was significantly increased (F =15.408-63.224, P<0.05) ;there was no significant change in GSK-3βprotein expression (P>0.05) . Conclusion Niweikang can effectively promote MC cell apoptosis, which may be related to its inhibition of activation of the Wnt/β-catenin signaling pathway.
Keyword: Niweikang; Stomach neoplasms; Precancerous conditions; Apoptosis; Wnt signaling pathway;
现阶段, 胃癌以其极高的发病率和死亡率成为癌症相关死亡的主要原因之一。据统计, 东亚地区人群中胃癌的发病率和死亡率均排在世界前列, 而我国在其中占据非常大的比例[1,2,3,4,5]。多数胃癌病人在肿瘤出现明显转移时才被发现和确诊, 5年生存率极低[6]。慢性萎缩性胃炎 (CAG) 伴肠上皮化生和不典型增生是胃癌的癌前病变[7]。现代医学尚未发现有特异性药物或者治疗手段可以抑制甚至逆转CAG向胃癌的演变, 如今临床上常用的治疗方案仅可以延缓病症的发展, 减轻病人的痛苦, 对于胃部器质性和功能性损伤的修复和逆转作用甚微。近年来, 传统中医药在治疗胃癌癌前病变 (PLGC) 方面取得了重大进展。
逆萎康是由青岛大学附属医院研制, 该方应用于临床多年, 对于CAG伴肠化生、不典型增生等癌前病变的治疗及胃癌术后的辅助治疗有良好的效果[8,9]。为减轻原逆萎康致呕这一副反应的发生, 早期对该组方进行了一系列优化。关于优化后的逆萎康组方发挥作用的具体机制尚不明确。本研究旨在探讨优化后逆萎康对胃癌前病变细胞 (MC细胞) 增殖、凋亡及对Wnt/β-catenin通路相关分子的影响, 以期能为PLGC的临床治疗寻找新的靶点。现将结果报告如下。
1 、材料与方法
1.1、 材料来源
MC细胞由青岛大学附属医院中心实验室馈赠;胎牛血清 (FBS) 、RIP细胞裂解液、PVDF膜和ECL化学发光试剂购自美国Millipore公司;RP-MI1640培养基及双抗 (青霉素和硫酸链霉素) 购自美国Hyclone公司;凋亡检测试剂盒购自日本DoJindo公司;c-myc、细胞周期素D1 (cyclin D1) 引物由华大基因合成;兔抗人B淋巴细胞瘤-2 (Bcl-2) 、Bcl-2相关X蛋白 (Bax) 、10号染色体上缺失的磷酸酶和紧张素同系物 (PTEN) 、半胱氨酸蛋白酶-3 (Caspase-3) 、β-连环蛋白 (β-catenin) 、糖原合成酶激酶3β (GSK-3β) 和磷酸化糖原合成酶激酶3β (pGSK-3β) 购买自美国Cell Signaling公司;兔抗人GAPDH购自武汉Elabscience公司;辣根过氧化物酶标记的羊抗兔二抗购自美国CST公司。
1.2 、细胞培养与逆萎康方剂的优化
将对数生长期MC细胞置于含体积分数0.10胎牛血清的RPMI 1640培养基中, 在37℃、含体积分数0.05CO2的细胞培养箱中进行无菌培养, 每2~3d传代1次, 镜下观察细胞贴壁达85%以上时, 以2.5g/L胰蛋白酶消化传代。
逆萎康方剂的优化:优化后的逆萎康方剂包括雪胆15g、黄!10g、老龙皮10g、半枝莲15g、海漂蛸10g、朱砂七3g、生姜6g、陈皮6g。将上述药材浸泡半小时后, 提取2次, 每次提取1h, 料液比为12倍, 水煎以后冷却, 经旋转蒸发后浓缩至含生药300g/L, 经0.22μm微孔滤膜过滤, 分装至离心管中, 置于-20℃冰箱保存, 用前以RPMI 1640培养液配制成所需浓度。
1.3 、流式细胞仪检测各组细胞凋亡情况
分别用0、100、200、300g/L的逆萎康孵育处理MC细胞48h后, 用预冷的PBS洗涤2次, 分别加入AnnexinV-FITC和PI solution各5μL, 轻轻混匀, 室温避光孵育15 min后, 加入1×Annexin V Binding Solution 400μL, 采用流式细胞仪检测细胞凋亡情况。
1.4 、实时荧光定量PCR (RT-qPCR) 技术检测c-myc、cyclin D1基因的表达
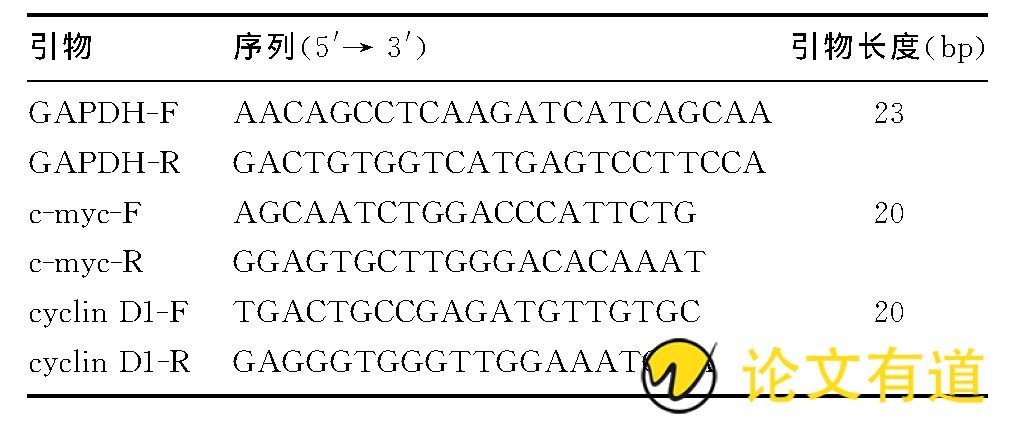
RT-qPCR的反应体系含ddH2O 7.0μL, SybrGreen qPCR Master Mix (2×) 10.0μL, 10μmol/L上游引物与10μmol/L下游引物各1.0μL, cDNA1.0μL, 总体积为20μL。扩增条件:95℃预变性10min;然后95℃30s, 60℃30s, 72℃30s, 进行40个循环。采用2-△△CT法计算各组mRNA的表达水平。见表1。
表1 逆转录PCR引物序列
1.5、 免疫印迹法 (Western Blot) 检测相关信号通路蛋白的表达
不同浓度的逆萎康处理MC细胞48h以后, 用RIPA裂解液裂解细胞后离心, 取上清液。在SDS-PAGE凝胶加样孔中分别加入30μg蛋白样品, 以80V30min、110V1h电泳分离蛋白, 并转移至PVDF膜上, 以体积分数0.05脱脂奶粉室温封闭1h, 然后分别将条带加入Bcl-2、Bax、Caspase-3、β-catenin、PTEN、GSK-3β、p-GSK-3β一抗液中, 4℃孵育过夜, TBST洗膜3次, 每次持续5 min, 二抗37℃孵育1h, TBST洗膜3次, 每次持续5 min, ECL显影。采用Image J软件分析目的蛋白条带和GAPDH灰度比值, 计算各种蛋白的相对表达量。
2、 结果
2.1、 逆萎康对MC细胞凋亡的影响
0、100、200、300g/L组细胞总凋亡率分别为 (4.32±0.70) %、 (6.12±0.00) %、 (8.02±1.04) %、 (15.82±2.52) %, 组间比较差异具有显着性 (F=24.864, P<0.05) ;200、300g/L组与0g/L组比较, 差异有显着性 (t=4.184、6.228, P<0.05) , 100g/L组与0g/L组比较, 差异无显着性 (P>0.05) 。
2.2、 逆萎康对MC细胞c-myc、cyclin D1基因表达的影响
0、100、200、300g/L组c-myc基因表达量分别为1.000±0.000、0.951±0.021、0.834±0.023、0.679±0.049, 组间比较差异具有显着性 (F=113.404, P<0.05) ;100、200、300g/L组与0g/L组比较, 差异均有显着性 (t=3.212~9.387, P<0.05) 。0、100、200、300g/L组cyclin D1基因的表达量分别为1.000±0.000、0.895±0.061、0.903±0.031、0.783±0.057, 组间比较差异具有显着性 (F=275.962, P<0.05) 。200、300g/L组与0g/L组比较, 差异有显着性 (t=4.422、5.507, P<0.05) , 100g/L组与0g/L组比较, 差异无显着性 (P>0.05) 。
2.3、 逆萎康对MC细胞Bcl-2、Bax、Caspase-3、β-catenin、PTEN、GSK-3β以及p-GSK-3β蛋白表达的影响
0、100、200、300g/L组Caspase-3、β-catenin、Bcl-2、p-GSK-3β蛋白表达量比较差异有显着意义 (F=14.783~63.224, P<0.05) ;100、200、300g/L组与0g/L组比较, 差异均有显着意义 (t=3.404~24.59, P<0.05) 。0、100、200、300g/L组Bax、PTEN蛋白的表达量比较差异具有显着意义 (F=30.529、15.408, P<0.05) ;200、300g/L组与0g/L组比较, 差异具有显着意义 (t=4.005~8.006, P<0.05) , 100g/L组与0g/L组比较, 差异无显着意义 (P>0.05) 。各组间GSK-3β蛋白的表达量比较, 差异均无显着性 (P>0.05) 。见图1~3, 表2、3。
3、 讨论
当前胃癌的治疗主要以手术及化疗、放疗、分子靶向治疗为主[10,11,12], 但化疗药物由于存在易产生耐药性、毒性较大且疗效有限等缺点, 应用范围受到极大限制。多年来传统中医在对CAG向胃癌的病程进展治疗方面, 积累了丰富的经验。中药组方逆萎康具有健脾和胃、清热导滞、益气止痛之功效。该组方可以显着地降低CAG的发病概率, 有效地抑制CAG向胃癌的转变。
目前对于胃癌的发病机制仍在持续探索当中, 至今依旧未有定论。值得肯定的是, 胃癌的发生和转归是受外界环境和机体自身因素影响的。机体中若干因子、基因以及信号通路都参与调节[13]。在人类各种癌症中, 尤其是晚期和转移性癌症中Wnt/β-catenin信号通路的调节一直处于激活的状态[14,15]。Wnt/β-catenin途径具有多个作用位点, 受多种信号途径调节, 该通路中任何组分的改变都可能导致信号转导异常, 从而导致肿瘤的发生[16]。Wnt/β-catenin及其上游相关信号的异常调节可致β-catenin在细胞中累积和易位, 并在进入细胞核后激活T细胞因子/淋巴增强因子转录活性, 导致下游基因的异常表达[17]。因此本研究探讨了逆萎康对β-catenin的影响, 并且进一步分析了逆萎康对cyclin D1[18,19,20]以及c-myc[21,22,23]基因表达的影响, 研究结果显示, 逆萎康处理MC细胞48h后, cyclin D1、c-myc蛋白水平明显降低, 提示逆萎康具有抑制Wnt/β-catenin通路的作用。
图1 逆萎康对MC细胞Bcl-2、Bax和Caspase-3蛋白表达的影响
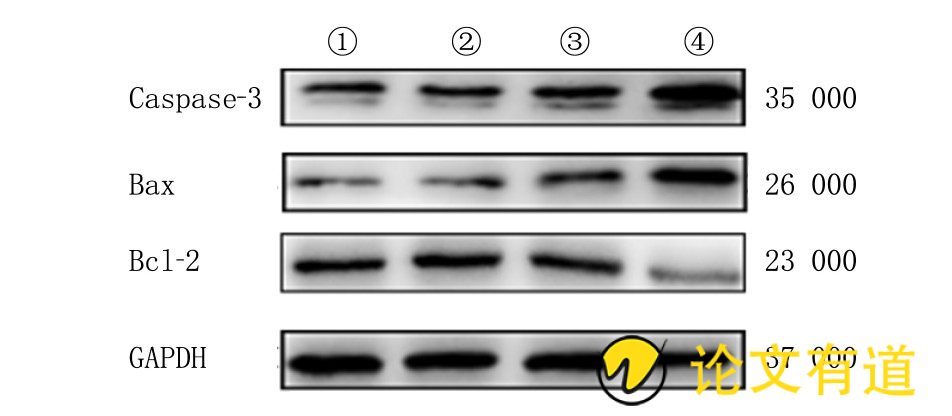
(1) 、 (2) 、 (3) 、 (4) 分别为0、100、200、300g/L组。
图2 逆萎康对MC细胞PTEN和β-catenin蛋白表达的影响
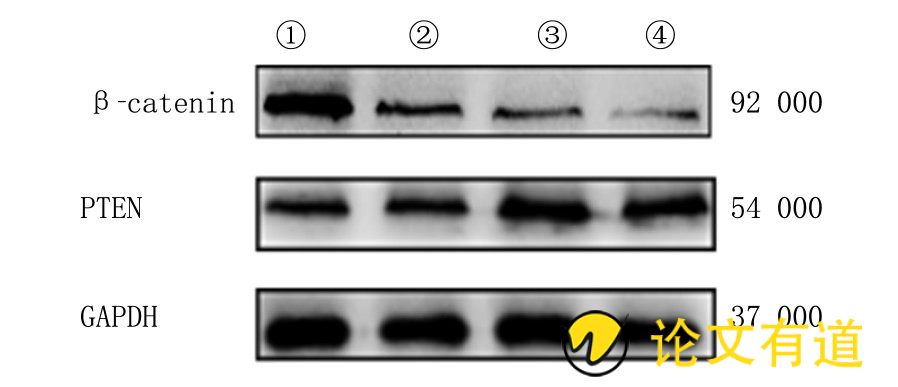
(1) 、 (2) 、 (3) 、 (4) 分别为0、100、200、300g/L组。
图3 逆萎康对MC细胞p-GSK-3β和GSK-3β蛋白表达的影响

(1) 、 (2) 、 (3) 、 (4) 分别为0、100、200、300g/L组。
表2 逆萎康对MC细胞Bcl-2、Bax和Caspase-3蛋白表达的影响

表3 逆萎康对MC细胞PTEN、β-catenin、p-GSK-3β和GSK-3β蛋白表达的影响

Bcl-2基因家族是凋亡过程中重要的组成部分。其中Bcl-2能够有效地抑制细胞凋亡, 其在多种肿瘤的发生进展中表达上调[24,25]。Bax能够诱导细胞进入凋亡程序, 与Bcl-2对凋亡的抑制作用恰好相反。在细胞凋亡信号通路中, Caspase-3位于通路的下游, 是凋亡过程的重要因子, 能够诱导细胞的凋亡[26,27]。逆萎康能够使MC细胞中促凋亡蛋白Bax和Caspase-3的表达上调, 抑制细胞凋亡蛋白Bcl-2的表达下调, 从而证实了逆萎康诱导MC细胞凋亡的作用。
GSK-3β在细胞内糖代谢、细胞增殖分化和凋亡等生理过程中起调控作用。GSK-3β异常表达和功能障碍可能导致一系列无法克服的疾病, 包括肿瘤、糖尿病和阿尔茨海默病等[28]。故本研究探讨了逆萎康对p-GSK-3β和GSK-3β表达的影响, 实验结果表明逆萎康对MC细胞中GSK-3β的表达无显着影响, 但其能够显着下调p-GSK-3β的表达水平。逆萎康可以通过抑制MC细胞中β-catenin的表达, 抑制GSK-3β磷酸化, 进而加速β-catenin的降解, 使β-catenin在MC细胞内的蓄积减少, 从而最终阻断Wnt/β-catenin信号通路的激活, 使得MC细胞的增殖和活化得到抑制。
PTEN是一重要的肿瘤抑制因子, 在大多数人类肿瘤中经常发生突变[29]。PTEN在细胞中控制着多种生物学过程, 包括维持基因组稳定性、细胞存活、迁移、增殖和代谢[30]。PTEN高甲基化可以导致PTEN蛋白的低表达, 进而引发胃肠道上皮的非典型增生, 在胃癌的发生和发展中PTEN的低表达起着重要作用[10]。本实验进一步对PTEN的表达检测显示, 逆萎康可诱导PTEN蛋白表达上调, 从而起到抗肿瘤的作用。
综上所述, 逆萎康抑制胃癌发生的机制可能通过增加PTEN的表达进而抑制Wnt/β-catenin通路的激活来实现, 最终抑制MC细胞的增殖, 促进其凋亡。相信通过后续更加深入的体内研究后, 能更进一步深入了解逆萎康治疗PLGC作用及其机制。
参考文献
[1]SITARZ R, SKIERUCHA M, MIELKO J, et al.Gastric cancer:Epidemiology, prevention, classification, and treatment[J].Cancer Manag Res, 2018, 10:239-248.
[2] STRAND M S, LOCKHART A C, FIELDS R C.Genetics of gastric cancer[J].Surg Clinlin North Am, 2017, 97 (2) :345-370.
[3]NIE Y, WU K, YU J, et al.A global burden of gastric cancer:The major impact of china[J].Expert Rev Gastroent, 2017, 11 (7) :651-661.
[4]VENERITO M, LINK A, ROKKAS T, et al.Gastric cancerclinical and epidemiological aspects[J].Helicobacter, 2016, 21 (S1) :39-44.
[5]LI Q, HU X, XUAN Y, et al.Kaempferol protects hives on gastric cancer[J].Gastroenterol Clin North Am, 2016, 45 (3) :413-428.
[6]QIU Y S, JIANG N N, ZHOU Y, et al.LMO, promotes gastric cancer cell invasion and proliferation through Akt-mTORand Akt-GSK3βsignaling[J].Int J Mol Med, 2018, 41 (5) :2755-2763.
[7]李榕萍.益生菌联合中药治疗慢性萎缩性胃炎的临床观察[J].海峡药学, 2016, 28 (4) :123-124.
[8]连慧芬, 张翠萍, 尹晓燕, 等.应用NBI-ME评价逆萎康对慢性萎缩性胃炎的疗效[J].青岛大学医学院学报, 2017, 53 (4) , 382-385.
[9]车聪, 乔雪静, 梁坤, 等.逆萎康方剂治疗慢性萎缩性胃炎效果观察[J].山东医药, 2015, 55 (36) :66-67.
[10]高丹丹, 刘磊, 白玉贤.晚期胃癌化疗及分子靶向治疗研究进展[J].中国肿瘤临床, 2012, 39 (23) :1978-1981.
[11]杨帅, 刘相良, 李理, 等.胃癌分子靶向治疗的研究进展[J].现代肿瘤医学, 2018, 26 (5) :784-789.
[12]王瑛, 段和力, 袁鹤立.胃癌综合治疗的研究进展[J].临床合理用药, 2018, 11 (1C) :168-169.
[13]马丽杰, 王惠吉, 武抗美.血清胃蛋白酶原与良、恶性溃疡[J].临床和实验医学杂志, 2007, 6 (5) :24-25.
[14]GUO A J, CHOI R C, CHEUNG A W, et al.Baicalin, a flavone, induces the differentiation of cultured osteoblasts:An action via the Wnt/beta-catenin signaling pathway[J].J Biol Chem, 2011, 286 (32) :27882-27893.
[15]NAGARAJ A B, JOSEPH P, KOVALENKO O, et al.Cirtical role of Wnt/β-catenin signaling in driving epithelial ovarian cancer platinum resistance[J].Oncotarget, 2015, 6 (27) :23720-23734.
[16]LI Q C, HU X X, XUAN Y H, et al.Kaempferol protects ethanol-induced gastric ulcers in mice via pro-inflammatory cytokines and NO[J].Acta Biochim Biophys Sin (Shanghai) , 2018, 50 (3) :246-253.
[17]MERVAI Z, SOLYOMVARY A, TOTH G, et al.Endogenous enzyme-hydrolyzed Fruit of cirsium brachycephalum:Optimal source of the antiproliferative lignan trachelogenin regulating the Wnt/β-catenin signaling pathway in the SW480colon adenocarcinoma cell line[J].Fitoterapia, 2015, 100:19-26.
[18]张凡, 齐鹏飞, 李道明, 等.甲状腺癌组织中GPX3和Bcl-2、cyclin D1蛋白的表达及意义[J].山东医药, 2018, 58 (25) :57-59.
[19]周洪涛, 李山林, 刘学进.Cyclin D1及TNFR1在腺瘤性息肉与胃癌中的表达意义[J].实用癌症杂志, 2019, 4 (2) :187-190.
[20]徐文敏, 何苗, 谭婧宇.幽门螺旋杆菌感染性胃癌组织中Cyclin D1、MMP9的表达及意义[J].临床与实验病理学杂志, 2019, 35 (2) :213-215.
[21]孙玉珍, 方毅, 于晓红, 等.组织红树莓根茎水煎剂对S180荷瘤小鼠肿瘤中c-myc、Cath-D表达的影响[J].海南医学院学报, 2019, 25 (9) :641-64, 649.
[22]杜清, 杨巧红, 张新江, 等.C-myc在胃癌治疗方面的研究进展[J].转化医学电子杂志, 2018, 5 (9) :53-58.
[23]褚云香, 翁艳, 王静, 等.幽门螺杆菌感染、c-myc和P53基因表达与胃癌的相关性研究[J].现代诊断与治疗, 2018, 28 (18) :2900-2901.
[24]ZHAO G, ZHU Y.Activation of the proapoptotic Bcl-2protein Bax by a small molecule induces tumor cell apoptosis[J].Mol Cel Biol, 2014, 34 (7) :1198-1207.
[25]ZHU Y, WU J, LI S, et al.The function role of miR-181ain chemosensitivity to adriamycin by targeting Bcl-2in low-invasive breast cancer cells[J].Cell Physiol Biochem, 2013, 32 (5) :1225-1237.
[26]董雅洁, 高维娟, 钱涛, 等.Bcl-2抑制剂对黄芪注射液降低缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的影响[J].中国病理生理杂志, 2016, 32 (6) :1051-1056.
[27]GEORGE B P, ABRAHAMSE H, PARIMELAZHAGAN T.Caspase dependent apoptotic activity of rubus fairholmianus gard.on MCF-7human breast cancer cell lines[J].J Appl Biomed, 2016, 14 (3) :211-219.
[28]李家平, 何涛, 袁红瑛.GSK-3β和E-cadherin在子宫内膜腺癌中的表达和意义[J].重庆医学, 2019, 48 (2) :288-292.
[29]NADERALI E, KHAKI A A, RAD J S, et al.Regulation and modulation of PTEN activity[J].Mol Biol Rep, 2018, 45 (6) :2869-2881.
[30]LEE Y R, CHEN M M, PANDOLFI P P.The functions and regulation of the PTEN tumour suppressor:New modes and prospects[J].Nat Rev Mol Cell Biol, 2018, 19 (9) :547-562.
[31]HAFSI S, PEZZINO F M, CANDIDO S, et al.Gene alterations in the PI3K/PTEN/AKT pathway as a mechanism of drug-resistance (review) [J].Int J Oncol, 2012, 40 (3) :639-644.

