
Abstract:OBJECTIVE To improve the dissolution rate of dabigatran etexilate (DBET) by prepared three-dimensional ordered macroporous starch material (3 DOMS) . METHODS 3 DOMS was prepared by hard template method, loaded DBET by solvent evaporation method. The dispersal state of DBET in DBET-3 DOMS sample was characterized by X-ray diffraction, differential scanning calorimetry and fourier transform infrared spectroscopy. Dissolution test was used to investigate the dissolution of DBET. RESULTS Macroporous ordered interconnected structure of 3 DOMS had the spatial restriction effect which could effectively limit the crystallinity of DBET. The dispersal state of DBET in DBET-3 DOMS sample was amorphous state. In vitro dissolution test showed the dissolution effect of DBET was enhanced obviously. CONCLUSION 3 DOMS can improve the dissolution of DBET and as biodegradable material exhibit promising potential in improving the water solubility of poorly soluble drugs.
Keyword:three-dimensional ordered macroporous starch material (3DOMS) ;poorly water-soluble drug;dabigatran etexilate;dissolution rate;
达比加群酯 (dabigatran etexilate, DBET) 是一种新型的、合成的直接凝血酶抑制剂, 是达比加群的前体药物, 属非肽类的凝血酶抑制剂[1,2,3,4]。DBET口服经胃肠吸收后, 在体内转化为具有直接抗凝血活性的达比加群。达比加群结合于凝血酶的纤维蛋白特异结合位点, 阻止纤维蛋白原裂解, 从而阻断了凝血瀑布网络的最后步骤及血栓形成。DBET属于难溶性药物, 绝对生物利用度为3%~7%[5,6]。目前有机多孔材料的发展为解决难溶性药物水溶性差的问题提供了新的思路, 其原理是利用纳米级孔道结构的空间限制效应, 降低药物粒子的大小, 降低药物的结晶度, 增加粒子比表面积, 从而改善其溶出速率。广泛应用于提高难溶性药物水溶性的有机多孔材料包括多孔淀粉泡沫、三维有序壳聚糖等[7,8]。但是有机多孔材料在制备过程中存在收缩和塌陷问题, 限制了其发展。本实验运用硬模板法制备三维有序大孔淀粉材料 (three-dimensional ordered macroporous starch material, 3DOMS) , 以DBET作为模型药物, 探索其改善难溶性药物水溶性的作用规律。

1、仪器与试药
RC-6型溶出度测定仪 (天津市光学仪器厂) ;IR Affinity-1型红外光谱仪、DSC-60型差示扫描量热仪 (日本岛津Shimadzu公司) ;2500PC型X射线衍射仪 (日本Rigaku公司) 。
DBET原料药 (湖北省圣宝莱生物科技有限公司, 批号:211915-06-09;含量>99.7%) ;无水乙醇、可溶性淀粉 (天津市光复精细化工有限公司) ;二氯甲烷、十二烷基硫酸钠为分析纯;甲醇为色谱纯。
2、方法与结果
2.1、3DOMS的制备[9,10]
将无水乙醇180 mL与水65 mL混合, 搅拌下逐一滴加氨水4.5 mL和正硅酸乙酯 (TEOS) 15 mL, 室温下反应4 h, 将产物抽滤, 乙醇洗涤3次, 60℃烘干, 得到实心二氧化硅纳米球约2 g (直径100 nm) 。将干燥的实心二氧化硅纳米球压实, 再放有滤纸的布氏漏斗中, 接着称取可溶性淀粉8 g加至100 mL去离子水中, 在100℃水浴下, 搅拌20 min, 得到澄清的淀粉溶液, 待温度降到80℃后, 将淀粉溶液滴加到压实的实心二氧化硅纳米球上, 开通真空循环泵, 让淀粉溶液渗入纳米球之间的空隙, 然后置4℃冰箱中使淀粉凝胶化, 35℃减压干燥12 h, 用10%的氢氟酸去除二氧化硅纳米球模板, 醇洗去除残留的酸, 经减压干燥得到3DOMS, 结构见图1。根据本实验室前期研究报道[10], 二氧化硅纳米球的大小可通过调节KCl的浓度进行控制, 可以制备得到100, 200, 400, 800和1 000 nm的二氧化硅纳米球模板, 进而制备不同孔径的3DOMS。其中以100 nm的二氧化硅纳米球作为模板, 制备得到的3DOMS能够使药物维持无定形态, 随着粒径增加, 药物以微晶态存在, 因此选择制备100 nm孔径的3DOMS。该工艺通过减压干燥法有效避免了结构框架的收缩和塌陷, 获得良好的纳米级框架结构, 非常适合作为药物储库。
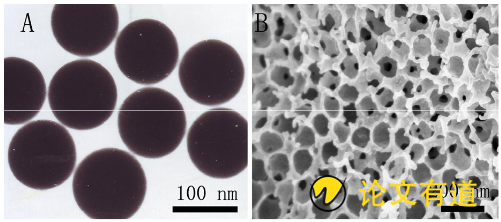
图1 实心二氧化硅纳米球的透射电镜图片和3DOMS的扫描电镜图片 (50 000×)
2.2、载药
采用溶剂浸渍挥发法[11], DBET被吸附进入3DOMS的纳米级连通的孔道中, 按药物∶载体质量比1∶1, 1∶3, 1∶5的比例进行载药。其过程为精密称取DBET和3DOMS, 将3DOMS粉末浸渍于DBET的二氯甲烷溶液中, 在密闭条件下, 搅拌4~5 h, 开盖, 室温搅拌下自然挥干。将不同比例的载药样品DBET-3DOMS在减压条件下干燥24 h, 除去残留的溶剂, 通过UV于222 nm波长处测量载药量。称取5 mg载药样品, 分散于甲醇20 mL中, 放置2 h后, 测紫外吸光度, 采用外标法计算载药量, 结果表明, 以1∶1, 1∶3和1∶5的比例进行载药得到DBET-3DOMS的载药量分别为 (50.6±1.31) %, (25.8±0.94) %, (17.2±1.04) % (n=3) 。
2.3、DBET-3DOMS的表征
2.3.1、差示扫描量热法 (DSC)
通过差示扫描量热仪考察药物相互转变温度变化, 样品包括DBET原料药、3DOMS载体、DBET和3DOMS物理混合物 (PM, 1∶1) 及DBET-3DOMS载药样品 (1∶1, 1∶3, 1∶5) 。氮气的流速为150 m L·min- (16) , 升温速度为10℃·min- (16) , 扫描范围为30~200℃, 结果见图2。DBET原料药和物理混合物有多个吸热峰, 表明DBET为多晶型药物, 药物和载体比例为1∶1的DBET-3DOMS样品有弱的吸热峰, 当随着载药比例增加时, DBET-3DOMS (1∶3和1∶5) 的吸热峰消失。推测原因是随着3DOMS比例的增加, DBET高度均匀地分散于3DOMS的三维孔道中, 其纳米级孔道的空间抑制效应限制了DBET结晶的形成, 使DBET以无定形态分散在三维孔道中。
2.3.2、粉末X射线衍射 (PXRD)
采用PXRD分别对DBET原料药、3DOMS载体、DBET和3DOMSPM (1∶1) 及DBET-3DOMS (1∶1, 1∶3, 1∶5) 进行表征, 考察药物结晶度变化, 扫描角度 (2q) 为3°~60°, 扫描速度为5°·min- (16) , 步长为0.02°, 结果见图3。3DOMS无特征衍射峰, DBET原料药存在多个特征衍射峰, 在16°最高, PM与其相符, DBET-3DOMS (1∶1) 中DBET有较弱的特征衍射峰, 而在DBET-3DOMS (1∶3和1∶5) 中DBET特征衍射峰消失, 该结果说明DBET均匀地吸附进入3DOMS的纳米级孔道, 三维有序纳米孔道限制了DBET结晶度, 使其最终以无定形状态存在, 这一结果与DSC一致。
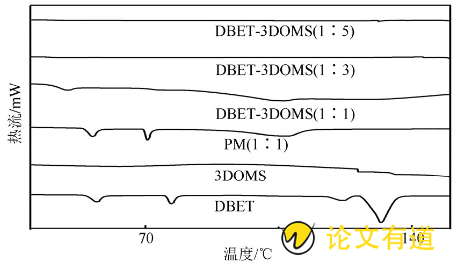
图2 DBET原料药、3DOMS、DBET和3DOMS PM (1∶1) 及DBET-3DOMS (1∶1, 1∶3, 1∶5) 的DSC曲线
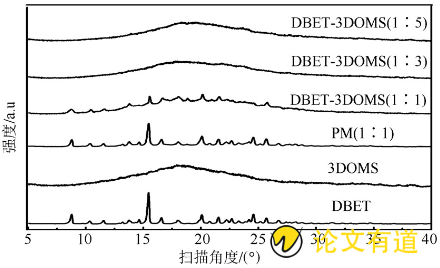
图3 DBET原料药、3DOMS、DBET和3DOMS PM (1∶1) 、DBET-3DOMS (1∶1, 1∶3, 1∶5) 的PXRD曲线
2.3.3、红外光谱 (FT-IR) 的测定
采用红外光谱仪分别对DBET原料药、3DOMS载体、DBET和3DOMS PM (1∶1) 及DBET-3DOMS (1∶1) 进行扫描, KBr作为背景, 波数范围为400~4 000 cm- (16) , 结果见图4。相比于DBET原料药与PM的红外光谱, DBET-3DOMS没有出现新峰或特征峰峰位变化, 表明3DOMS对DBET的吸附属于物理吸附[10]。
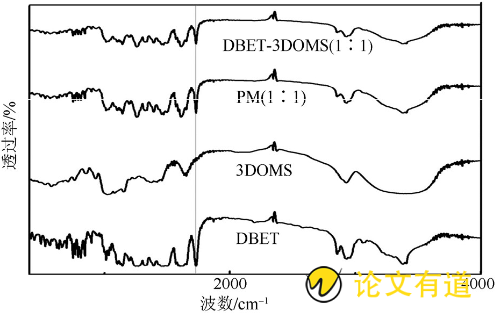
图4 DBET、3DOMS、PM (1∶1) 及DBET-3DOMS (1∶1) 的IR曲线
2.4、DBET检测
2.4.1、波长扫描
精密称取DBET, 用甲醇溶解后加0.01%SDS的pH 3.0盐酸 (0.001 mol·L- (16) ) 配制浓度为10μg·mL- (16) 的药物溶液;照该方法同样配制10μg·mL- (16) 的3DOMS溶液, 紫外分光光度计在200~400 nm内进行光谱扫描, 实验结果显示DBET在222 nm紫外吸收最强, 3DOMS在该波长处无干扰, 所以选择222 nm为检测波长。
2.4.2、标准曲线测定
精密称取DBET原料药5 mg, 用甲醇溶解并定容至10 m L, 制成500μg·mL- (16) 贮备液。采用0.01%SDS的盐酸溶液 (pH 3.0) 继续配制浓度为1, 2.5, 5, 10, 25, 50, 100μg·mL- (16) 的系列溶液, UV测定DBET的吸光度 (A) , 以浓度 (c) 与A拟合得到线性方程A=0.062 4c 0.413, r=0.999 3, 这表明DBET在1~100μg·mL- (16) 内有良好线性关系。
2.4.3、回收率试验
精密称定一定量的3DOMS, 置于0.01%SDS盐酸溶液 (pH 3.0) 中, 精密移取不同量DBET贮备液, 配制低, 中和高浓度 (5, 25和50μg·mL- (16) ) 样品溶液, 1 d内分别测定5次, 计算得DBET的回收率分别为98.92%, 99.13%, 99.05%, RSD分别为0.95%, 1.06%和1.12% (n=5) 。
2.4.4、精密度试验
配制DBET浓度为低、中、高浓度 (5, 25和50μg·mL- (16) ) 的样品溶液, 1 d内分别测定5次, 计算得日内RSD分别为0.4%, 0.6%和0.7%;连续5 d测定, 计算得日间RSD分别为0.48%, 0.82%和0.85%。
2.5、表观溶解度测定
取一定量DBET和DBET-3DOMS分别置于磨口锥形瓶中, 加入一定量的蒸馏水, 确保成为过饱和溶液, 在37℃恒温空气浴摇床中振摇, 平衡72 h后抽取溶液, 经0.45μm微孔滤膜过滤, UV平行测定5次, 计算DBET的水中表观平衡溶解度, 依照此法测定DBET和DBET-3DOMS在0.01%SDS的盐酸溶液 (pH 3.0) 中的平衡溶解度。结果表明, DBET和DBET-3DOMS (1∶5) 的水中表观平衡溶解度分别为 (1.52±0.34) 和 (62.5±0.52) μg·mL- (16) , 在0.01%SDS的盐酸溶液 (pH 3.0) 中的表观平衡溶解度分别为 (135.6±0.41) 和 (956.5±0.29) μg·mL- (16) 。3DOMS显着改善了DBET在水和0.01%SDS的盐酸溶液 (pH 3.0) 中的溶解性, 原因在于3DOMS的三维有序纳米孔道降低了药物的粒子大小, 药物粒子比表面积增大, 溶解性提高。
2.6、溶出度测定
依照中国药典2015年版 (附录XC第二法) 测定累积溶出度。分别称取20 mg的DBET原料药和不同比例的DBET-3DOMS (相当于DBET20 mg) , 以0.01%SDS的盐酸溶液 (pH 3.0) 为溶出介质, 体积为900 mL, 搅拌桨转速为100 r·min- (16) , 温度为 (37±0.5) ℃, 分别在5, 10, 15, 20, 30, 45, 60 min抽取5 mL介质, 0.45μm微孔滤膜过滤, 同时补等体积空白介质, 滤液于222 nm波长处测定吸光度, 计算累积溶出度, 结果见图5。不同比例的DBET-3DOMS的溶出速率均高于DBET原料药, 且随着载体比例增加, 药物溶出速率加快。DBET原料药在1 h时, 累积溶出度为35.7%, 相比之下, DBET-3DOMS (1∶5) 的累积溶出度>99%。原因在于3DOMS的纳米孔道降低了DBET结晶度, 减小药物粒径, 进而增大药物粒子的比表面积, 从而显着改善DBET的溶出速率[12]。
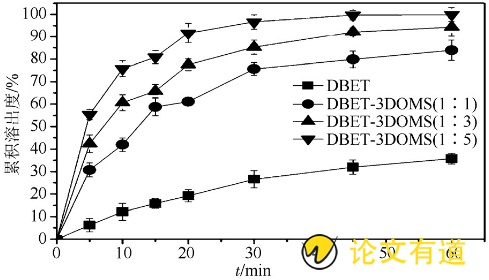
图5 DBET原料药和DBET-3DOMS (1∶1, 1∶3, 1∶5) 的溶出度曲线 (n=3)
3、讨论
DBET在水中表观溶解度极低, 具有pH依赖性, pH为1.0时, 溶解度为13.49 mg·mL- (16) ;pH为2.0时, 溶解度为1.89 mg·mL- (16) ;pH≥3时, 几乎不溶[13,14]。本研究测定了pH为3时的溶解度为1.52μg·mL- (16) , 为了避免pH对溶出的影响, 并充分反映载体对溶出速率的影响, 选择0.01%SDS的盐酸溶液 (pH 3.0) 作为溶出介质。
根据本实验室之前的研究报道[10], 通过不同粒径二氧化硅纳米球作为模板, 制备得到的具有不同孔径大小的3DOMS, 其中100 nm的孔道能够使难溶性药物维持无定形态, 溶出效果较好。所以本实验采用100 nm孔径的3DOMS为载体材料。3DOMS改善DBET溶出速率的原因为3DOMS的纳米级孔道空间抑制效应抑制了药物的结晶, 使其以无定形态存在, 进而减小药物粒径, 并增加药物粒子比表面积, 改善水难溶性药物的溶出, 提高其口服生物利用度。
参考文献
[1]VAN R J, STANGIER J, HAERTTER S, et al.Dabigatran etexilate-a novel, reversible, oral direct thrombin inhibitor:interpretation of coagulation assays and reversal of anticoagulant activity[J].Thromb Haemostasis, 2010, 103 (6) :1116-1127.
[2]HIJAZI Z, HOHNLOSER S H, OLDGREN J, et al.Effcacy and safety of dabigatran compared with warfarin in relation to baseline renal function in patients with atrial fibrillation[J].Circulation, 2014, 130 (22) :961-970.
[3]FALTAS B.A new anticoagulant for a new era:review of recent data on dabigatran etexilate[J].Clin Adv Hematol Oncol, 2010, 8 (10) :697-702.
[4]ZHANG Y X, DING M P.Dabigatran etexilate, a novel oral anticoagulant for stroke prevention in patients with atrial fibrillation[J].Chin J New Drugs (中国新药杂志) , 2012, 21 (11) :1227-1231, 1236.
[5]LIU X Q, ZHENG C L, DENG Y F, et al.Preparation and evaluation of dabigatran etexilate solid self-microemulsion dispersible tablets[J].Chin J New Drugs (中国新药杂志) , 2017, 26 (16) :1942-1947.

