摘要:甜瓜的苦味是由葫芦烷型三萜化合物导致, 其中以葫芦素B为主。葫芦素B是植物的“天然农药”, 可以抵御病虫侵害, 且对人类具有一定的药用价值。为筛选优良的甜瓜品种, 高效合成和改良葫芦素, 为后期新型药物研发创造条件, 文章总结了甜瓜苦味物质的化学结构及检测方法, 并简要归纳了葫芦素B的生物合成及代谢调控途径, 指出葫芦素二烯醇合酶是葫芦素B合成的关键酶, 另外果实中苦味物质的积累受一类转录因子的调控。并对今后甜瓜苦味育种方向和未来发展前景进行了展望, 以期为甜瓜苦味的深入研究提供参考。
关键词:甜瓜; 葫芦烷型三萜化合物; 葫芦素B; 生物合成;

0 引言
甜瓜是葫芦科在全球范围内种植最为广泛的经济作物之一, 因果实香甜、营养价值丰富以及具有独特的香气而备受广大消费者的青睐。然而在生产过程中, 遗传、环境或栽培因素会使果实带有苦味, 严重影响果实品质, 导致收益损失。
苦味在植物界分布广泛, 葫芦科植物含有的苦味主要是由葫芦素造成的[1]。葫芦素是植物防御病虫害的有效武器, 是保护植物的“绿色农药”[2,3,4,5]。尽管苦味不受人们欢迎, 但因其具有巨大的药用潜力, 已引起越来越多科学家的关注。甜瓜瓜蒂具有消炎及护肝的功效, 在中国作为一种传统药材被广泛使用。最新研究发现, 局部应用葫芦素B可导致表皮增生和炎性细胞因子显著减少, 进而改善银屑病症状[6]。此外, 葫芦素能够特异阻断肿瘤细胞生长所需的JAK-STAT信号通路, 从而抑制癌细胞如肺癌[7]、骨肉瘤[8]、胃癌[9]、胰腺癌[10]等的扩散。
笔者对甜瓜苦味物质的化学结构、生物合成及代谢调控途径进行综合分析和汇总, 以期为筛选优良的甜瓜品种及更好利用葫芦素药用功效的相关研究提供参考。
1 甜瓜苦味物质组成及检测
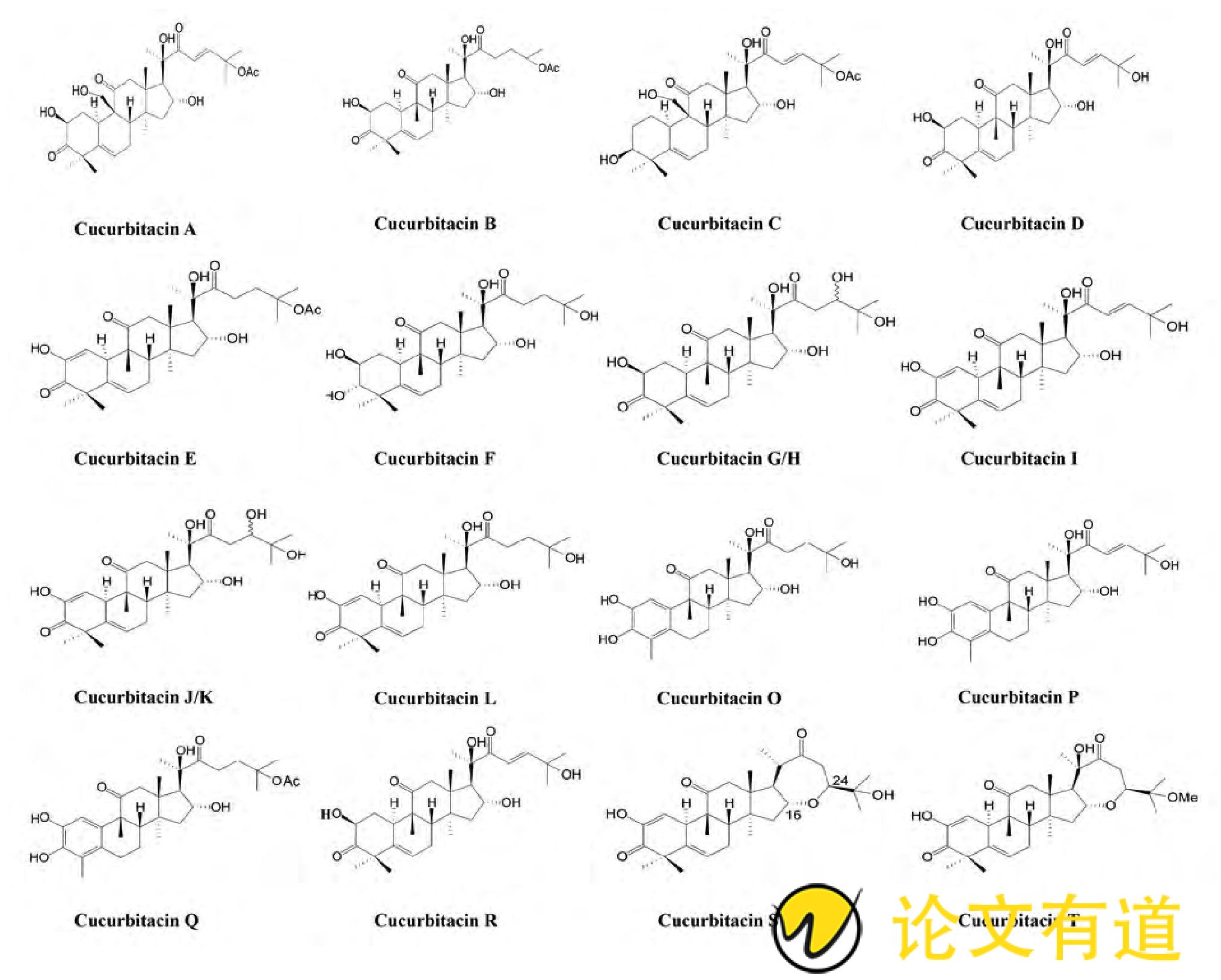
甜瓜苦味主要是由三萜化合物葫芦素B导致的[11]。葫芦素是葫芦科植物的特征化合物, 是一类高度氧化的四环三萜类植物次生物质, 具备环戊烷骈多氢菲的基本母核。葫芦素的种类很多, 根据碳骨架氧化程度和氧化位置不同, 大致可分为葫芦素A~T[1] (图1) 。
甜瓜个体之间苦味差异明显, 苦味在茎蔓和果实中均有体现。对相关甜瓜蒂成分检测分析表明, 其苦味成分主要含葫芦素B、葫芦素E、葫芦素D、异葫芦素B、葫芦素B葡萄糖苷等, 其中葫芦素B占80%以上[12]。黄三文等[11]对授粉后15天的甜瓜果实进行检测分析也发现, 在苦味明显的甜瓜果实中均存在葫芦素B成分, 而在不苦的果实中无葫芦素B成分的存在。其他葫芦科植物均有苦与不苦植株, 西瓜 (Citrullus lanatus var.lanatus) 和黄瓜 (Cucumis sativus) 的苦味也与葫芦素密切相关, 苦味西瓜和苦味黄瓜中分别富含葫芦素E和C[11,13,14]。此外, 在瓠瓜 (Lagenaria siceraria) [15]、丝瓜 (Luffa cylindrical) [[16]], 冬瓜 (Benincasa hispida) [17]中也检测到葫芦素类苦味物质。
目前, 感官品尝是育种专家用来判断苦味存在与否的主要方法。采用感官品尝的方法效率高, 但受品尝者对苦味敏感程度的制约, 评价结果的可信性差, 且不适合大批量的筛选样品。现已报道的研究苦味检测方法最多的是液相色谱法[[18,19,20]-20], 该方法准确度高、重复性好, 可用于检测样品中葫芦素的含量。此外, 唐慧敏等[21]在研究苦味评价方法时指出电子舌检测方法具有客观性、重复性、不疲劳、检测速度快、数据电子化和易保存等优点。田玉兰等[22]设计了一种基于雄鼠精细胞的细胞阻抗传感器, 用于苦味物质的特异性检测, 为代替动物和人的苦味测试提供了一种新的可能。上述方法均有不足之处, 因此当前亟待开发一种简单、快捷、高效的苦味鉴定方法, 为深入研究苦味形成的分子机理和培育无苦味品种提供重要的价值。
图1 各类葫芦素的化学结构

2 葫芦素B的生物合成及调控
2.1 葫芦素B骨架的形成及修饰
葫芦素B属于葫芦烷型三萜化合物, 植物体内的三萜化合物骨架的生物合成始于甲羟戊酸途径合成的产物异戊二烯焦磷酸 (Isopentenyl diphosphate, IPP) 和二甲烯丙基焦磷酸 (Dimethylallyl diphosphate, DMAPP) , 该类产物在一系列催化酶[主要包括法尼基焦磷酸合酶 (Farnesyl pyrophosphate synthase, FPS) , 鲨烯合酶 (Squalene synthase, SQS) 和鲨烯单加氧酶或环化酶 (Qualene monooxygenase or epoxidase, SQE) ]作用下形成2, 3-氧鲨烯[23,24]。通常情况下, 所有的三萜化合物骨架都由一类氧化鲨烯环化酶 (Oxidosqualenecyclases, OSCs) 家族催化2, 3-氧鲨烯的船式或椅式构象形成 (图2) 。
OSC家族在植物中广泛存在, 根据其催化机理不同将OSC家族分为β-香树素合成酶 (beta-Amyrin Synthase, β-AS) [[25]], 达玛烷二醇合成酶 (Dammarenediol Synthase, DS) [[26]], 环阿屯醇合成酶 (Cycloartenol Synthase, CAS) [[27]], 羽扇豆醇合成酶 (Lupeol Synthase, LUS) [[28]], 羊毛甾醇合成酶 (Lanosterol Synthase, LS) [28]和α-香树素合成 (alpha-Amyrin Synthase, α-AS) 几类。不同OSC的催化机制各异, 最终催化生成各类特异的三萜类化合物。
在甜瓜中, 2, 3-氧鲨烯的船式构象被OSC催化形成葫芦烷二烯醇 (cucurbitadienol) , 其被认为是葫芦素B化合物的基本骨架。迄今, Zhou等[11]对葫芦素B在甜瓜体内的代谢合成过程进行了概述, 并克隆验证了甜瓜OSC家族成员CmBi是控制葫芦素B骨架生物合成的关键基因。近年来, 越来越多的OSC基因不断在其他葫芦科植物中被发现, Hayashi等[29]在丝瓜中克隆出了合成泻根醇酸的OSC基因LcIMS1;3个OSC基因 (CPX、CPQ和CPR) 分别从西葫芦的根中被克隆出来, 其中CPQ编码葫芦烷二烯醇合酶, 是控制葫芦素类三萜化合物在西葫芦中合成的第一步[[30]];Davidovich-Rikanati[14]克隆了西瓜3个OSC基因 (CcCDS1、CcCDS2和ClCDS1) , 其中CcCDS2编码葫芦烷二烯醇合酶;CsBi编码葫芦烷二烯醇合酶, 在黄瓜中被鉴定出来[11,13,31]。
葫芦烷型三萜化合物基本骨架形成后, 还需多种修饰酶的参与才能最终形成有差异的葫芦烷型三萜化合物[32,33]。氧化还原酶CYP450 (Cytochrome P450) 家族在三萜化合物骨架功能化过程中发挥关键作用, CYP450的氧化修饰主要包括引入羟基、酮基、醛基、羧基和环氧基团等, 此修饰所引入的官能团为糖基转移酶和酰基转移酶等的进一步修饰提供了条件。
2.2 葫芦素B合成通路解析
葫芦素B属于次级代谢物质, 植物中次生代谢产物合成基因往往在基因组上成簇分布。例如玉米中的DIBOA基因簇[34]、拟南芥中的Marneral基因簇[35]和Thalianol基因簇[36]、黄瓜中的葫芦素C基因簇[37]、西瓜中的葫芦素E基因簇[[11,13], 13] (图3) 。基因簇共同调控一组基因, 控制生物合成或发育通路的连续步骤。
已知甜瓜中葫芦素B的生物合成共涉及到8个基因 (表1) , 现已探明4步催化反应, 受同一个基因簇的调控。葫芦素B合成相关的基因簇位于甜瓜11号染色体, 包括1个OSC (CmBi) 基因、1个酰基转移酶基因和4个CYP450基因, 此外, 还有2个CYP450基因在葫芦素B的生物合成中起作用, 以上8个基因在甜瓜各组织中共表达。
图2 三萜化合物葫芦素B的生物合成途径
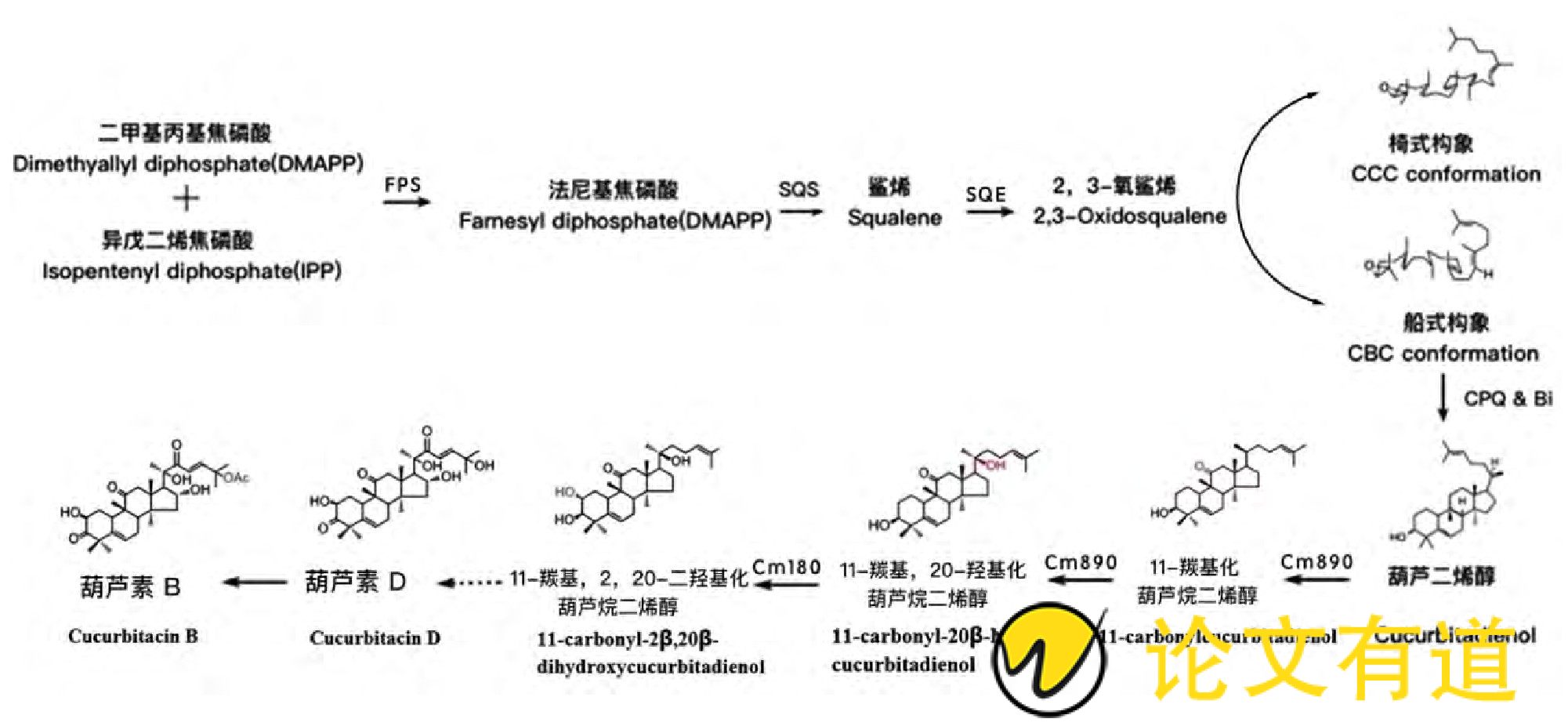

图3 拟南芥marneral基因簇、thalianol基因簇、黄瓜葫芦素C基因簇、西瓜葫芦素E基因簇以及甜瓜葫芦素B基因簇的分布
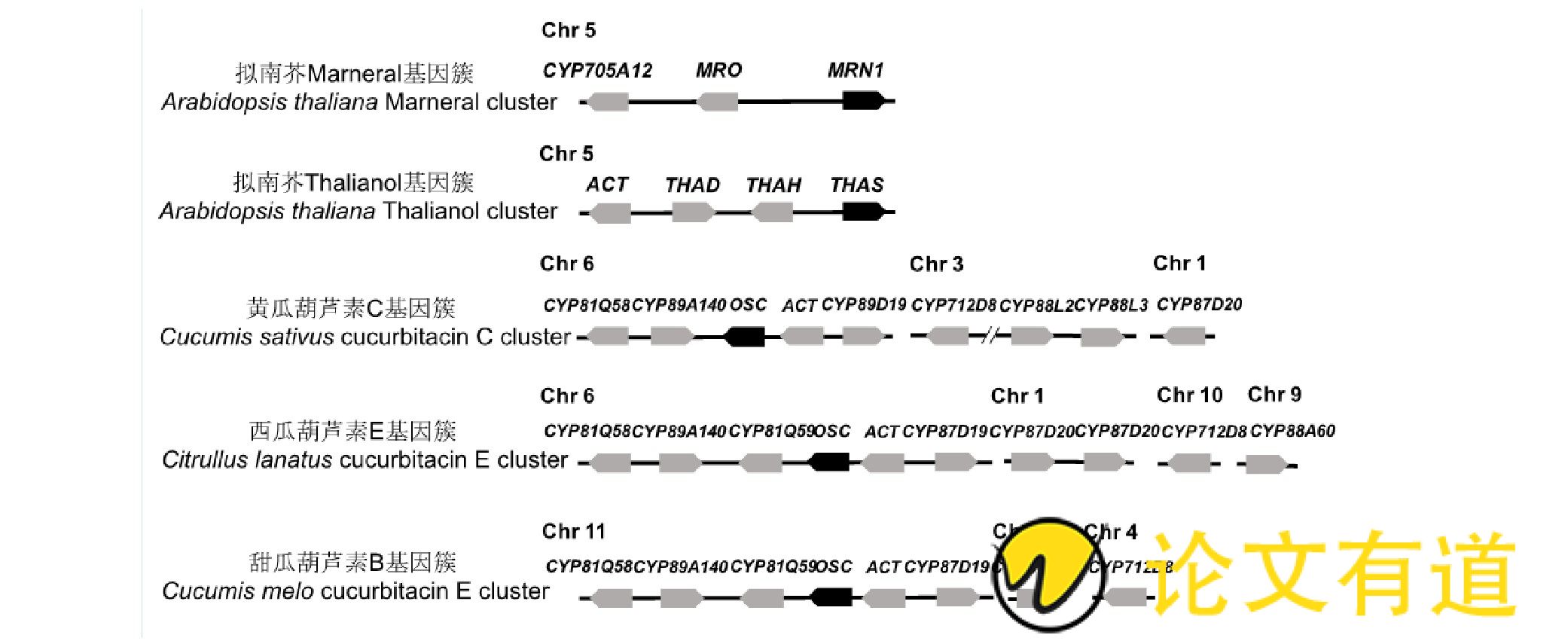

黑色方块为OSC家族基因;灰色方块表示修饰基因, 其中CYP、MRO、THAD、THAH均属于CYP450家族基因, ACT表示酰基转移酶基因
表1 甜瓜中与葫芦素B生物合成及调控相关的基因
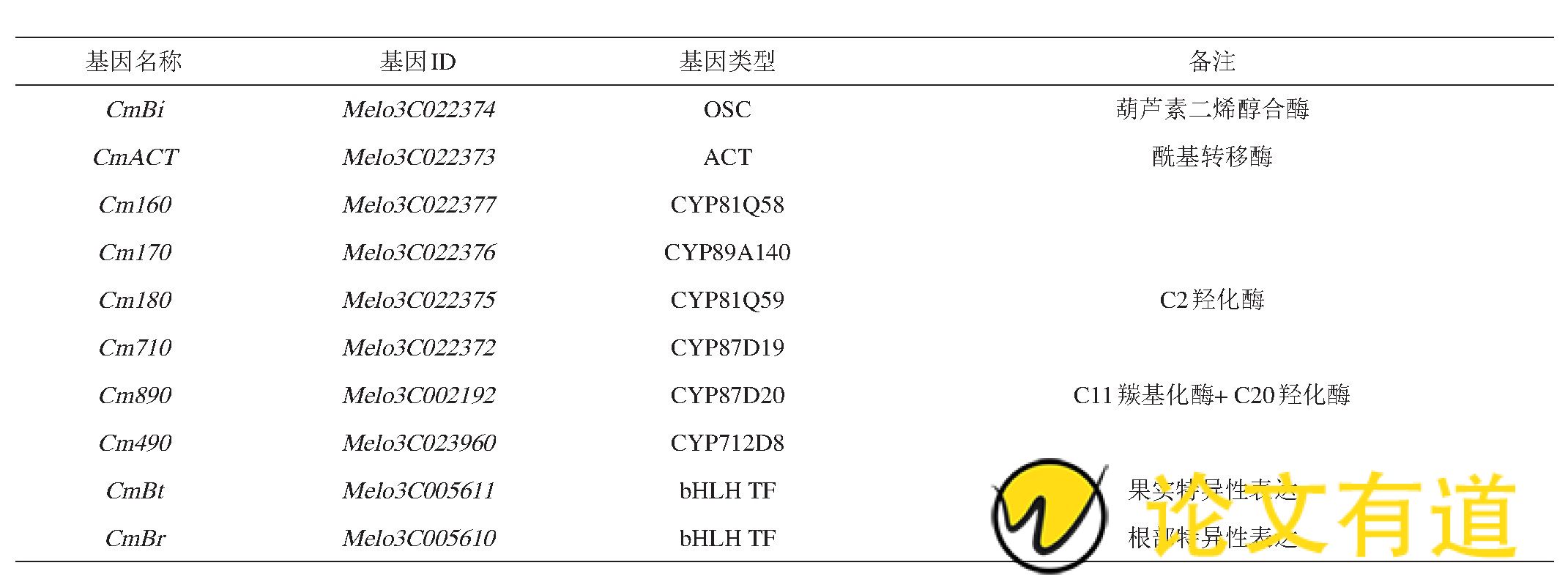

其中CmBi编码的2, 3-氧化角鲨烯环化酶 (OSC) 催化2, 3-氧化角鲨烯环化生成葫芦二烯醇, 是负责催化苦味合成的第一步关键限速步骤;第二步, 葫芦烷二烯醇在氧化酶Cm890作用下C-11羰基化, C-20羟基化, 形成11-羰基, 20-羟基化葫芦烷二烯醇;第三步, 11-羰基、20-羟基化葫芦烷二烯醇在氧化酶Cm180催化下形成11-羰基, 2, 20-二羟基化葫芦烷二烯醇;最后一步, 葫芦素D在CmACT作用下生成葫芦素B (图2) 。
2.3 调控葫芦素B合成的“开关”基因
转录因子CmBr (Bitter root) 与CmBt (Bitter fruit) 分别编码bHLH家族的转录因子, 调控CuB合成的基因簇内所有基因的表达。bHLH是一类含有basic helixloop-helix (bHLH) 结构域的转录因子, 包括碱性区域、螺旋-环-螺旋 (HLH) 2个不同的功能区域[38,39]。CmBt可与CmBi基因启动子上游782 bp部位的E-box (5'-CACATG-3') 结合直接调控CmBi表达, 在不同试验材料中CmBr表达量与CmBi表达量及苦味含量呈正相关[11]。CmBr与CmBt决定着葫芦素B在甜瓜根和果实中的形成, 分别是根和果实中特异调控苦味合成的“开关”基因。
3 展望
3.1 葫芦素B的生物合成
葫芦素B具有很大的药用潜力, 当前相关药物的开发中, 所需的葫芦素主要从葫芦科作物中分离提取得到。葫芦素B在植物中的含量较低, 后期提取纯化工艺复杂且耗时, 需投入大量的人力物力等资源[40]。此外, 葫芦素B属于大分子物质且结构复杂, 现今要实现对葫芦素B的化学合成仍存在诸多挑战。随着甜瓜中葫芦素B等葫芦素合成通路的解析, 运用转基因技术及合成生物学方法, 将葫芦素B合成代谢通路转入酵母中, 利用生物发酵技术实现对葫芦素B快速、高效合成和改良, 为相关药物的开发开辟了新的思路。
3.2 果实无苦味甜瓜的驯化
葫芦科作物苦味已经成为国内外研究的热点, 研究主要集中于无苦味品种的选育。分子标记辅助育种技术是在农作物的遗传育种工作中应用最为广泛的技术之一。黄三文等[13]在控制黄瓜果实苦味合成的转录因子CsBt中发现了一个SNP变异位点, 可使得黄瓜果实苦味完全被驯化, 并在此变异位点的基础上设计了相关的CAPS分子标记, 可应用于黄瓜无苦味品种的选育。而在甜瓜品种中, 相关的分子标记选育工作至今还未报道, 接下来急需开发与甜瓜果实苦味相关的分子标记, 结合传统杂交育种技术实现对无苦味果实甜瓜的驯化。
另外, 随着高通量测序技术的发展, 通过对全基因组序列信息的分析, 在分子水平上实现对苦味基因更深入的挖掘及其调控机制的揭示, 为培育可食部位无苦味但叶片和根茎等可食部位有苦味的甜瓜品种奠定理论基础。随着甜瓜苦味合成、代谢分子机制的解析, 可通过控制葫芦素B合成的关键基因CmBi和果实中的“开关”基因CmBt培育完全无苦味的优良甜瓜品种。亦可调控根中的“开关”基因, 促进葫芦素B在根部合成进行虫害防御, 减少农药使用。
3.3 甜瓜苦味物质的转运机制
葫芦素是植物防御病虫害的有效武器, 同时也对自身细胞产生毒性[1]。在黄瓜中其借助运输蛋白将有毒物质储存在液泡或排除体外, 或者通过糖基转移酶对葫芦素C化合物进行修饰, 从而避免自身细胞受到伤害[41,42]。而在甜瓜中也可能存在相应的保护机制, 接下来可利用比较基因组学在甜瓜基因组中筛选出可能与葫芦素B等转运相关的因子, 并进一步进行功能验证, 揭示甜瓜苦味相关物质的转运机制。
参考文献
[1] Chen J C, Chiu M H, Nie R L, et al.Cucurbitacins and cucurbitane glycosides:structures and biological activities[J].Natural Product Reports, 2005, 22 (3) :386-399.
[2] Tallamy D W, Stull J, Ehresman N P, et al.Cucurbitacins as Feeding and Oviposition Deterrents to Insects[J].Environmental Entomology, 1997, 26 (3) :678-683.
[3] Balkema-Boomstra A G, Zijlstra S, Verstappen F W A, et al.Role of Cucurbitacin C in Resistance to Spider Mite (Tetranychus urticae) in Cucumber (Cucumis sativus L.) [J].Journal of Chemical Ecology, 2003, 29 (1) :225-235.
[4] Da Costa C P, Jones C M.Cucumber Beetle Resistance and Mite Susceptibility Controlled by the Bitter Gene in Cucumis sativus L.[J].Science, 1971, 172 (3988) :1145-1146.
[5] Metcalf R L, Metcalf R A, Rhodes A M.Cucurbitacins as kairomones for diabroticite beetles[J].Proceedings of the National Academy of Sciences of the United States of America, 1980, 77 (7) :3769-3772.
[6] Li Z J, Shin J M, Choi D K, et al.Inhibitory effect of cucurbitacin Bon imiquimod-induced skin inflammation[J].Biochemical&Biophysical Research Communications, 2015, 459 (4) :673-678.
[7] Marostica L L, Alb D B, Oliveira J, et al.Antitumor effectiveness of a combined therapy with a new cucurbitacin B derivative and paclitaxel on a human lung cancer xenograft model[J].Toxicology&Applied Pharmacology, 2017, 329:272-281.
[8] Zhang Z R, Gao M X, Yang K.Cucurbitacin B inhibits cell proliferation and induces apoptosis in human osteosarcoma cells via modulation of the JAK2/STAT3 and MAPK pathways[J].Experimental&Therapeutic Medicine, 2017, 14 (1) :805-812.
[9] Liu X, Duan C, Ji J, et al.Cucurbitacin B induces autophagy and apoptosis by suppressing CIP2A/PP2A/mTORC1 signaling axis in human cisplatin resistant gastric cancer cells[J].Oncology Reports, 2017, 38 (1) :271-278.
[10] Zhou J, Zhao T, Ma L, et al.Cucurbitacin B and SCH772984exhibit synergistic anti-pancreatic cancer activities by suppressing EGFR, PI3K/Akt/mTOR, STAT3 and ERK signaling[J].Oncotarget, 2017, 8 (61) :103167-103181.
[11] Zhou Y, Ma Y, Zeng J, et al.Convergence and divergence of bitterness biosynthesis and regulation in Cucurbitaceae[J].Nature Plants, 2016, 2:16183.
[12] 吴军侠, 赵红侠.高效液相色谱法测定甜瓜蒂中葫芦素B含量[J].化学与生物工程, 2010 (1) :92-94.
[13] Shang Y, Ma Y, Zhou Y, et al.Plant science.Biosynthesis, regulation, and domestication of bitterness in cucumber[J].Science, 2014, 346 (6213) :1084-1088.
[14] Davidovich-Rikanati R, Shalev L, Baranes N, et al.Recombinant yeast as a functional tool for understanding bitterness and cucurbitacin biosynthesis in watermelon (Citrullus spp.) [J].Yeast, 2015, 32 (1) :103-114.
[15] 李林章, 马崇坚, 应泉盛, 等.瓠瓜苦味栽培生理研究初报[J].安徽农学通报, 2007 (16) :98-99.
[16] 罗燕华.有棱丝瓜苦味形成的原因及预防措施[J].上海蔬菜, 2013 (1) :44-45.
[17] 陈颢, 李丽娟, 万伟超, 等.旱冬瓜化学成分的研究[J].云南大学学报:自然科学版, 2013, 35 (4) :542-548.
[18] Wang Z, Zhu W, Gao M, et al.Simultaneous determination of cucurbitacin B and cucurbitacin E in rat plasma by UHPLC-MS/MS:A pharmacokinetics study after oral administration of cucurbitacin tablets[J].Journal of Chromatograph B Analytical Technologies in the Biomedical&Life Science, 2017, 1065-1066:63-69.
[19] 魏榕, 伍忠军, 杨玛丽, 等.甜瓜蒂中葫芦素提取工艺初探及其含量测定[J].成都医学院学报, 2016 (4) :402-405.
[20] 马启武, 赵海誉.甜瓜蒂中主要四环三萜结构鉴定及葫芦素B, 葫芦素D含量测定[J].中国实验方剂学杂志, 2017 (8) :77-81.
[21] 唐慧敏, 任麒, 沈慧凤.苦味评价方法的国内外研究进展[J].中国新药杂志, 2009 (2) :127-131.
[22] 田玉兰, 苏凯麒, 邱先鑫, 等.基于鼠精细胞的味觉阻抗传感器用于苦味物质检测的研究[J].传感技术学报, 2016 (12) :1785-1790.
[23] Chappell J.The genetics and molecular genetics of terpene and sterol origami[J].Current Opinion in Plant Biology, 2002, 5 (2) :151-157.
[24] Thimmappa R, Geisler K, Louveau T, et al.Triterpene Biosynthesis in Plants[J].Annual Review of Plant Biology, 2014, 65 (1) :225-231.
[25] Kushiro T, Shibuya M, Ebizuka Y.Beta-amyrin synthase--cloning of oxidosqualene cyclase that catalyzes the formation of the most popular triterpene among higher plants[J].European Journal of Biochemistry, 1998, 256 (1) :238-244.
[26] Huang Z, Lin J, Cheng Z, et al.Production of dammarane-type sapogenins in rice by expressing the dammarenediol-II synthase gene from Panax ginseng C.A.Mey[J].Plant Science, 2015, 239:106-114.
[27] Basyuni M, Oku H, Tsujimoto E, et al.Cloning and functional expression of cycloartenol synthases from mangrove species Rhizophora stylosa Griff.and Kandelia candel (L.) Druce[J].Biosci Biotechnol Biochem, 2007, 71 (7) :1788-1792.
[28] Husselsteinmuller T, Schaller H, and Benveniste P.Molecular cloning and expression in yeast of 2, 3-oxidosqualene-triterpenoid cyclases from Arabidopsis thaliana[J].Plant Molecular Biology, 2001, 45 (1) :75-92.
[29] Hayashi H, Huang P, Inoue K, et al.Molecular cloning and characterization of isomultiflorenol synthase, a new triterpene synthase from Luffa cylindrica, involved in biosynthesis of bryonolic acid[J].European Journal of Biochemistry, 2001, 268 (23) :6311-6317.
[30] Shibuya M, Adachi S, Ebizuka Y.Cucurbitadienol Synthase, the First Committed Enzyme for Cucurbitacin Biosynthesis, Is a Distinct Enzyme from Cycloartenol Synthase for Phytosterol Biosynthesis[J].Tetrahedron, 2004, 60 (33) :6995-7003.

