摘 要: 黑色素瘤是目前恶性程度最高的肿瘤之一。临床上,常采用维罗非尼(PLX4032)作为晚期患者的治疗药物,但患者很快就出现了耐药。因此,如何克服耐药、提高患者生存率成为急需解决的问题。本文选用中药吴茱萸碱(EVO)与黑色素瘤A375细胞、对PLX4032耐药的A375细胞(A375/R)进行相关研究。采用CCK-8法检测发现,用EVO的细胞非毒性浓度0.5 μmol/L处理A375/R,PLX4032对A375/R细胞的半数抑制浓度(IC50)降低,逆转倍数为3.85。显示EVO能够增强黑色素瘤A375/R细胞对PLX4032的敏感性。后续实验分为对照组、EVO组、PLX组、PLX EVO组。流式细胞仪检测结果显示,EVO组细胞凋亡率为5.88%,PLX组细胞凋亡率为17.88%,PLX EVO组细胞凋亡率为30.28%。细胞集落结果证明,PLX4032联合EVO能够抑制A375/R细胞的克隆形成。免疫印迹法结果证明,联合用药能够上调促凋亡蛋白质Bax、胱天蛋白酶3的表达量,下调p-Akt、p-NF-κB-p65及抗凋亡蛋白Bcl-2的蛋白质水平。以上结果均表明,EVO能够有效逆转黑色素瘤A375/R细胞耐药,并且诱导细胞凋亡,抑制细胞增殖。
关键词: 吴茱萸碱; 维罗非尼; 黑色素瘤细胞; 耐药;
Abstract: Melanoma is one of the most malignant tumors at present. Vemurafenib (PLX4032) is often used as a drug for the treatment of advanced patients, but patients quickly develop drug resistance. Therefore, how to overcome drug resistance and improve the survival rate of patients has become an urgent problem yet to be solved. In this paper, evodiamine (EVO), A375 cells and PLX4032-resistant A375 cells (A375/R) were used to carry out the related experiments. After A375/R cells were treated with the non-toxic concentration of EVO, the 50% inhibition rate (IC50) of PLX4032 decreased, and the reversal fold was 3.85 times more. It was shown that EVO could enhance the sensitivity of melanoma A375/R cells to PLX4032. The following experiments were divided into the control group, EVO group and PLX group, PLX EVO group. The results of flow cytometry showed that the apoptosis rate of the EVO group was 5.88%, that of the PLX4032 group was 17.88%, and that of the PLX4032 combined with EVO group was 30.28%. The colony assay showed that PLX4032 combined with EVO could inhibit the colony formation of A375/R cells. Western blotting showed that the combination of drugs could up-regulate the expression of the apoptosis-promoting protein Bax, Cascapse-3 and down-regulate the protein levels of p-Akt, p-NF-κB-p65 and the anti-apoptosis protein Bcl-2. These results suggested that EVO can effectively reverse the drug resistance of melanoma A375/R cells, induce apoptosis and inhibit the proliferation of melanoma A375 cells.
Keyword: evodiamine(EVO); vemurafenib(PLX4032); melanoma cells; drug resistance;
黑色素瘤是一种起源于皮肤、黏膜、脉络膜黑色素细胞的恶性肿瘤。由于患者的存活率极低,曾一度被认为是最具侵袭性和治疗复发性的皮肤癌[1]。研究发现,40%~60%黑色素瘤患者存在BRAF基因突变,其中最常见的突变方式是BRAFV600E突变。维罗非尼(vemurafenib,PLX4032)是靶向BRAF突变的小分子生物抑制剂,在国际上是晚期黑色素瘤的一线治疗药物。而遗憾的是,PLX4032的有效性平均持续仅6个月,患者很快出现了获得性耐药。因此,发现一种新的治疗药物,或者对PLX4032新的辅助治疗手段成为一件刻不容缓的事情[2,3]。

吴茱萸碱(evodiamine,EVO)是一种天然的吲哚生物碱,是吴茱萸的主要生物活性成分之一,其抗肿瘤功效越来越多地被国内外学者发现[4]。有研究报道,吴茱萸碱在肺癌、肝癌和结肠癌等多种肿瘤中均有着促凋亡、抗侵袭的作用[5,6,7]。除此之外,吴茱萸碱还可逆转结肠中由ABCG2所介导的药物抗性[8]。也有报道表明,吴茱萸碱使胶质母细胞瘤对TRAIL敏感[9]。而吴茱萸碱对于耐药黑色素瘤细胞的相关研究却鲜有报道。本研究以人黑色素瘤细胞A375及其耐PLX4032细胞(A375/R)为研究对象,初步探讨吴茱萸碱对黑色素瘤耐药细胞的影响及其机制,为解决黑色素瘤的耐药问题寻找新的思路,同时为吴茱萸碱的临床应用提供实验依据。
1、材料与方法
1.1、材料
高糖DMEM细胞培养基购自Hyclone公司,胎牛血清购自四季青公司,吴茱萸碱、PLX4032购自美国Selleck生物科技有限公司,胰蛋白酶、结晶紫染液、BCA蛋白质浓度试剂检测盒(增强型)、RIPA裂解液(强)均购自碧云天生物科技有限公司,双染色法试剂Annexin V-FITC/PI购自杭州Multi Sciences公司,Counting Kit-8(CCK-8)试剂盒购于Dojindo公司,凝胶配制试剂盒购自上海雅酶生物科技有限公司,Bax、Bcl-2、胱天蛋白酶3、β-肌动蛋白抗体购自Santa Cruz公司,Akt、p-Akt、NF-κB-P65和p-NF-κB-P65均购自Cell Signaling Technology公司。
1.2、 细胞及其培养
人恶性黑色素瘤细胞A375、对PLX4032耐药的A375细胞(A375/R)均由本实验室提供。将上述两种细胞在含有10%胎牛血清、1%青霉素和链霉素的DMEM培养基中培养。除此之外,A375/R细胞的培养基中需要额外添加2 μmol/L PLX4032以维持其耐药性并在后续实验前2周将药撤去。将细胞置于37℃,5%CO2的孵箱中孵育,根据细胞状况对其进行换液或传代的操作。
1.3、 CCK-8法检测PLX4032、EVO单独或联合处理对A375、A375/R细胞增殖的影响
取处于对数生长期的A375和A375/R细胞,以每孔8 000个细胞的密度接种于96孔板中,置于细胞培养箱中培养24 h,加入一系列浓度梯度的PLX4032药物。在37 ℃,5%CO2孵箱中培养48 h,弃细胞悬液,每孔加入110 μL CCK-8混合液(CCK-8溶液∶完全培养基=1∶10),孵箱中放置2~4 h,在450 nm波长下检测其吸光度A 值。根据结果,检测PLX4032对两种细胞的增殖抑制情况,计算PLX4032的半数抑制浓度IC50与耐药倍数RI。抑制率=[(A对照组-A实验组)/(A对照组-A空白组) ]。耐药倍数RI= IC50 (A375/R) / IC50 (A375)。按照上述方法检测EVO对两种细胞的非细胞毒性剂量IC10和半数抑制浓度IC50。
根据上述获得的结果,进行两种药物的联合用药实验。取A375/R细胞按前述方法接种于96孔板中24 h,加入上述浓度梯度的PLX4032,同时每孔加入药物EVO(使混合液中EVO终浓度为IC10),孵箱孵育48 h,加入CCK-8混合液放置2~4 h,检测PLX4032对A375/R细胞的增殖抑制率。
1.4、流式细胞术检测药物处理对细胞凋亡的影响
将A375/R细胞以0.8×106 /皿的细胞密度接种于60 mm细胞培养皿中。分为4个组:对照组、EVO组、PLX组、PLX EVO组。待其培养到对数生长期时,进行加药处理。加药浓度分别为EVO 0.5 μmol/L、PLX4032 10 μmol/L、PLX4032 10 μmol/L EVO 0.5 μmol/L。在37 ℃,5%CO2孵箱中培养48 h,收集细胞悬液,运用流式细胞仪Annexin VPI双染色法检测细胞凋亡率。
1.5、细胞克隆形成实验检测药物处理对细胞增殖的影响
将A375/R细胞接种于6孔板中,调整细胞密度为500个细胞/孔,以十字方向摇晃数次,使其在40倍镜显微镜下,每个视野平均分布1~2个细胞。孵箱培养1周后,镜下观察。若大多数单个克隆细胞数超过50时,终止克隆。弃上清,用多聚甲醛固定10 min或更长时间,弃液,用PBS清洗2次后加入结晶紫染色5 min,PBS清洗2次。观察并拍照,用Image J对6孔板中各个组的克隆形成集落数进行计数,将实验组克隆数与对照组克隆数进行比较,计算克隆形成比,运用Graphpad prism进行图表绘制。
1.6、免疫印迹法分析药物处理对凋亡相关蛋白质表达的影响
离心收集A375/R细胞,用细胞全蛋白质裂解液经过冰上裂解、超声破碎和4℃离心提取蛋白质。BCA蛋白质浓度测定试剂盒检测蛋白质浓度,加入缓冲液煮沸蛋白质,室温冷却,�80 ℃存放蛋白质。
蛋白质样品经SDS凝胶电泳分离,经120 V电泳30 min。同时准备PVDF膜,待电泳结束取出胶切膜,200 mA,0.80 min/kD下电转。牛奶封闭PVDF膜,一抗孵育,4℃过夜。复温,用TBST洗膜4次,二抗孵育1 h。再用TBST洗膜4次,用ETC发光仪显影。用目的条带灰度值与内参条带灰度值的比值作为蛋白质的相对表达水平。
1.7、统计学分析
每个实验重复3次以保证结果的可靠性,所有分组数据均用Mean±SD表示。采用SPSS Statistic 19.0进行统计学分析,多组均数间比较采用单因素方差分析,统计值P<0.05表示差异有统计学意义。
2、结果
2.1、 吴茱萸碱增加黑色素瘤细胞对PLX4032的敏感性
利用CCK-8法在450 nm波长下,分别检测 PLX4032、吴茱萸碱单独或联合处理48 h对A375细胞和A375/R细胞的增殖抑制率。结果显示,PLX4032对A375和A375/R细胞的半数抑制浓度IC50分别为2.21 μmol/L和40.45 μmol/L。经过计算,A375/R对药物PLX4032的耐药倍数RI约为18.31(Fig.1A,1B)。吴茱萸碱对A375和A375/R细胞的半数抑制浓度IC50分别为4.94 μmol/L和5.29 μmol/L,非细胞毒性剂量均为0.5 μmol/L(Fig.1C, 1D)。 在Fig.1E中,浅色条柱表示单独用PLX4032作用48 h时,A375/R细胞的增殖趋势。深色条柱表示使用0.5 μmol/L(非毒性剂量)吴茱萸碱联合浓度梯度的PLX4032作用48 h,A375/R细胞的增殖趋势。结果显示,当PLX4032联合吴茱萸碱作用于A375/R细胞时,其半数抑制浓度由原来的40.45 μmol/L降低到10.50 μmol/L,计算得出其逆转倍数为3.85。
Fig.1 EVO can obviously enhances the chemosensitivity of melanoma cells to PLX4032

(A-D) A375, A375/R cells were treated with indicated concentrations of PLX4032 or EVO for 48 hours. (E) A375/R cells were treated with PLX4032 alone or in combination with 0.5 μmol/L EVO for 48 hours. Cell viability was determined using the CCK-8 assay. Data are mean ± SEM, n=3
2.2 、PLX4032联合吴茱萸碱促进黑色素瘤细胞凋亡
应用流式细胞仪对细胞凋亡进行检测。结果显示:对照组细胞凋亡率为5.06%,吴茱萸碱组(0.5 μmol/L)细胞凋亡率为5.88%,PLX4032组(10 μmol/L)细胞凋亡率为17.88%,PLX4032联合吴茱萸碱组(10 μmol/L 0.5 μmol/L)细胞凋亡率为30.28%。结果证明,与对照组相比,吴茱萸碱组和PLX4032组均可以诱导A375/R细胞发生凋亡,其中联合用药组细胞凋亡率明显增多。结果具有显着性差异(P<0.001)(Fig.2)。
Fig.2 PLX4032 combined with EVO can promote apoptosis of melanoma cells
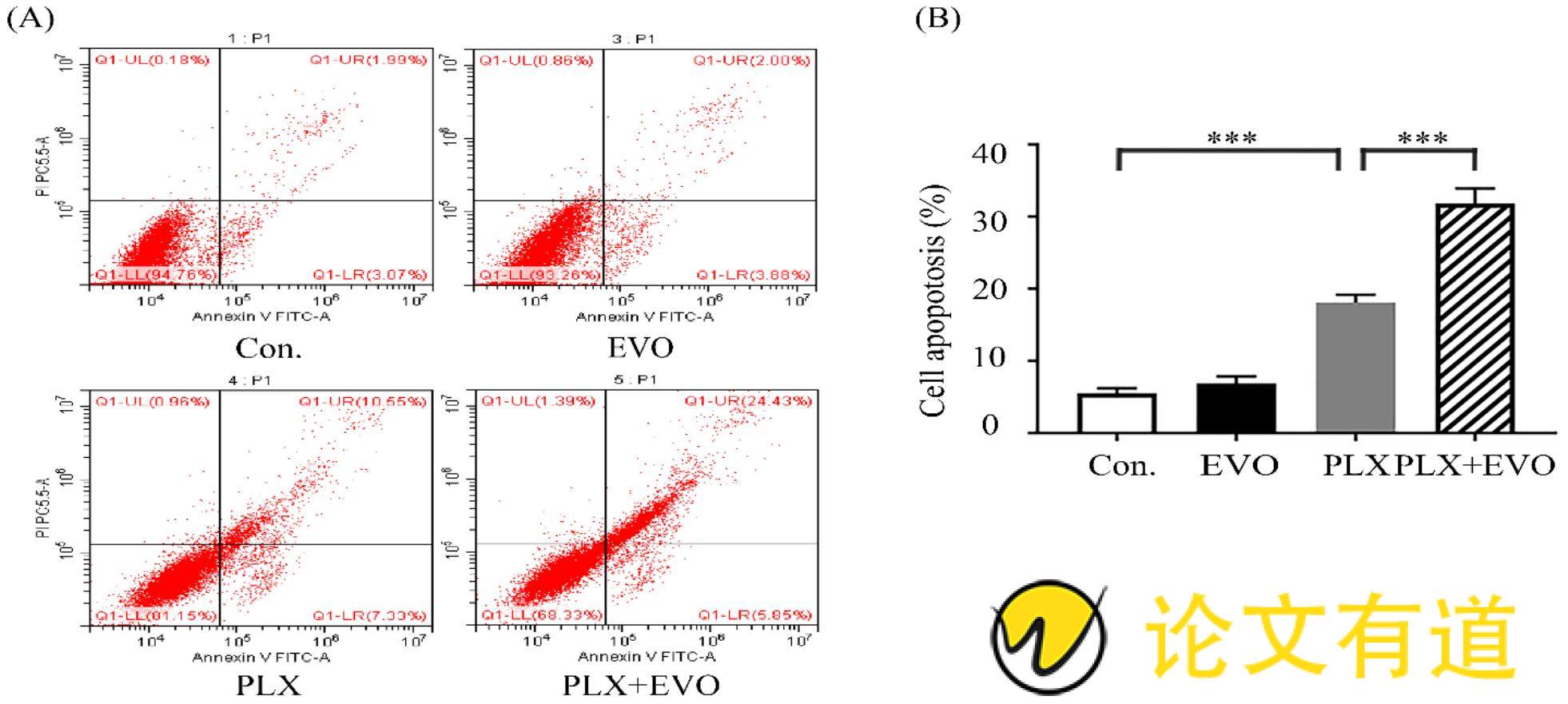
(A) A375/R cells were treated with PLX alone or combination with EVO for 48 hours. The apoptosis level was measured by Annexin V/FITC plus propidium iodide double staining and flow cytometry. (B) Data are mean ±SEM, n=3. ***P<0.001
2.3、 PLX4032联合吴茱萸碱促进黑色素瘤细胞克隆形成
利用细胞克隆形成实验探究联合用药对细胞增殖能力的影响。结果显示:相比10 μmol/L PLX4032对细胞的作用,PLX4032联合0.5 μmol/L 吴茱萸碱能够显着地抑制A375/R细胞的克隆形成。表明了吴茱萸碱能够增加PLX4032的抗增殖能力。与对照组相比,PLX组克隆形成率为40.42%,联合用药组克隆形成率为13.75%。其结果显示,联合用药组克隆形成率明显减少,结果具有显着性差异(*P < 0.05, **P<0.01)(Fig.3)。
Fig.3 PLX combined with EVO can inhibit the ability of cell colony formation

(A) A375/R cells were treated with PLX alone or combination with EVO for 48 hours. The colony formation assay showed long-term (21-days treatment) anti-proliferative effects of PLX4032 and EVO against A375/R cells. (B) Data are mean ±SEM, n=3, *P < 0.05, **P<0.01
2.4、 PLX4032联合吴茱萸碱对蛋白质表达水平的影响
利用免疫印迹实验检测PLX4032单独或联合吴茱萸碱对于凋亡相关蛋白质的影响。结果显示,0.5 μmol/L 吴茱萸碱联合10 μmol/L PLX4032可以明显上调Bax、胱天蛋白酶3在蛋白质水平的表达,下调Bcl-2在蛋白质水平的表达,从而促进细胞凋亡。除此之外,与对照组相比,PLX4032联合0.5 μmol/L吴茱萸碱对Akt和p65的蛋白质表达量未见影响,但能够显着下调磷酸化Akt、p65的蛋白质水平(Fig.4)
Fig.4 Effects of EVO and PLX4032 on protein expression of A375/R cells
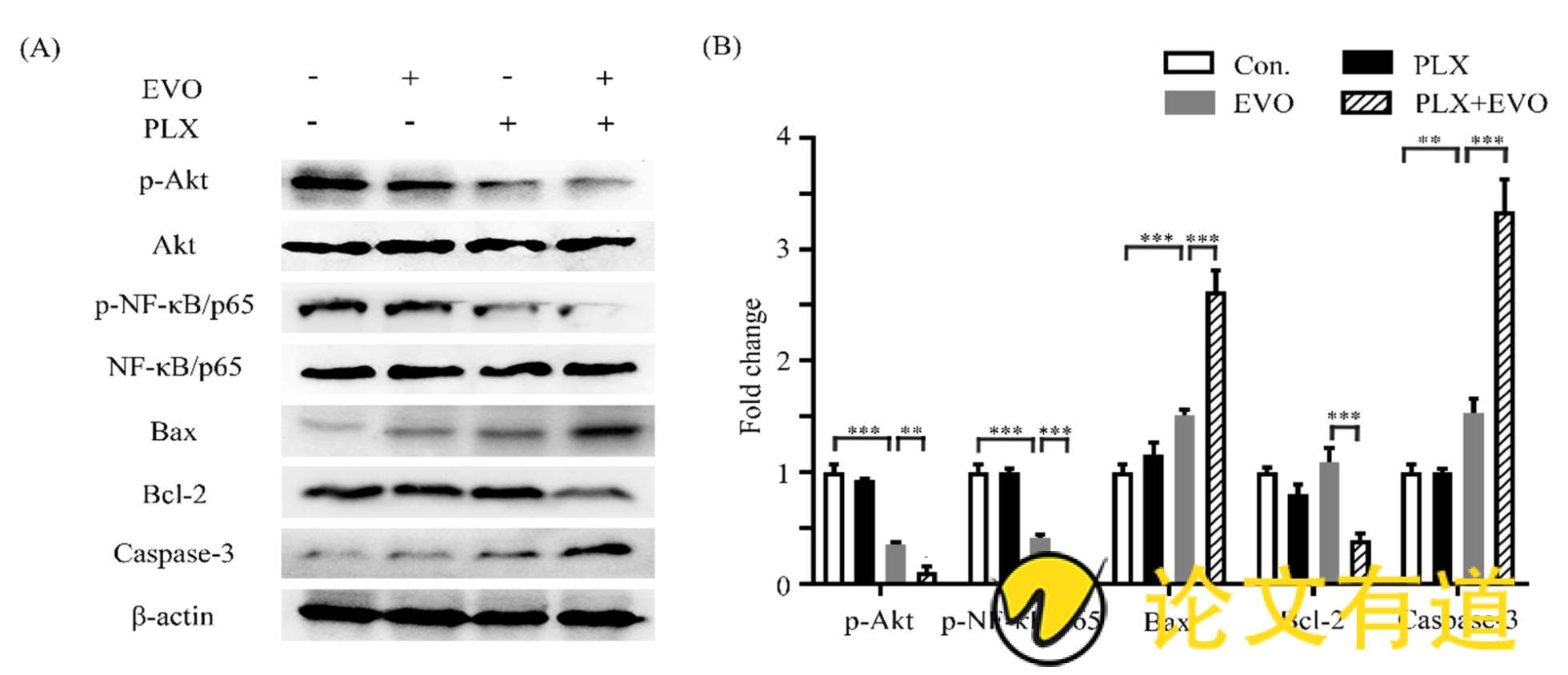
(A) After A375/R cells were treated with PLX4032 alone or combination with EVO for 48 hours, cell lysates was prepared. Cell lysates were subjected to Western blotting using the specific antibodies indicate. β-Actin was used as an loading control. (B) The amount of proteins was quantified by the integrated density (Image J) of each band. **P<0.01, ***P<0.001
3、讨论
目前,黑色素瘤是世界上最严重的恶性肿瘤之一,其发病率在世界范围内不断上升[10,11] 。大约40%~60%的黑色素瘤均存在BRAF突变,BRAF V600E突变是黑色素瘤中最常见的突变形式,约占黑色素瘤中BRAF突变的75%~90%[12]。临床研究表明,BRAF靶向抑制剂PLX4032能够明显提高患者的生存率。但随着时间的推进,越来越多的患者对其产生耐药[13]。尽管FDA批准的PLX4032和Dabrafenib、Trametinib等的联合治疗方法,在短期对患者的病情有改善,但耐药问题仍然不可避免地出现[14,15]。因此,寻找新的治疗方案以提高患者的生存率成为目前国际研究的热点与重点。
目前,中药在疾病治疗的舞台上发挥着越来越重要的作用。吴茱萸碱是我国的一味传统中药吴茱萸的有效成分,其抗肿瘤作用不断被学者所报道[16,17]。本文运用黑色素瘤细胞A375、A375/R (对PLX4032耐药的A375细胞),拟探究吴茱萸碱对黑色素瘤细胞的影响。本文首先运用CCK-8法检验PLX4032对两种细胞的细胞毒性作用差异。结果证明,PLX4032在两种细胞中的作用差异明显,A375/R的耐药倍数约为18.31倍。由此,本文对吴茱萸碱在黑色素瘤细胞中的作用进行了探究,并根据结果筛选出了吴茱萸碱对两种细胞的非细胞毒性剂量0.5 μmol/L。根据以上的结果,本文以IC10的吴茱萸碱联合维罗非尼作用于A375/R细胞并进行CCK-8检测。结果证明,A375/R细胞对PLX4032的敏感性明显增加,其IC50从40.47 μmol/L降低到10.50 μmol/L,逆转倍数约为3.85倍。以上结果证明了吴茱萸碱能够增强黑色素瘤耐维罗非尼细胞的药物敏感性。基于以上的研究,本文运用克隆形成实验对联合用药的细胞克隆形成能力进行了探究,结果同样印证了前述情况。
细胞凋亡的逃避可能有助于肿瘤的发展、进展以及治疗抵抗。目前,可用的大多数抗癌疗法(包括化疗,放射和免疫疗法)主要通过激活细胞死亡途径,即癌细胞凋亡发挥作用[18]。 肿瘤细胞有多种分子机制来抑制细胞凋亡。
PI3K/Akt信号通路在肿瘤的发生以及发展等过程中均发挥重要作用,其具有调节肿瘤细胞的增殖和活化等过程的功能。该通路在多种肿瘤中被异常激活,不仅对细胞的恶变具有促进作用,还能促进恶变后的肿瘤细胞侵袭、转移、新生血管以及耐药等过程的发生发展。研究发现,在肿瘤细胞中,PI3K/Akt通路被激活后,可以调节其下游的凋亡相关蛋白质,如Bcl-2和Bax蛋白,使Bcl-2/Bax值升高,发挥抑制肿瘤细胞凋亡的作用。
NF-κB是一类核转录因子。目前,NF-κB在肿瘤发生、发展中的作用已得到广泛的认可。研究已经证实,NF-κB通路在肿瘤细胞中持续活化,诱发下游信号通路的异常激活或失活,促进肿瘤细胞过度增殖、肿瘤恶性进展及治疗耐药[19]。抗凋亡蛋白质Bcl-2处于NF-κB通路的下游,NF-κB-p65的活化可导致Bcl-2蛋白表达上调,抑制细胞凋亡,促进肿瘤进展。
肿瘤细胞可通过上调抗凋亡蛋白质Bcl-2的表达量或通过下调或突变促凋亡蛋白质,例如Bax的表达量而获得对细胞凋亡的抗性。细胞凋亡的重新激活不仅直接触发癌细胞死亡,而且还降低了细胞凋亡的阈值,从而使肿瘤细胞对凋亡敏感[20,21]。本文对联合用药的细胞凋亡情况进行了探究,通过流式细胞术发现,PLX联合吴茱萸碱可以促进黑色素瘤耐药细胞凋亡。通过免疫印迹实验对细胞的凋亡相关蛋白质进行了检测,发现通过联合用药可以显着下调p-Akt、p-NF-κB-p65及 Bcl-2的蛋白质水平,上调Bax、胱天蛋白酶3在蛋白质水平的表达。该结果表明,联合用药可以通过抑制Akt和NF-κB-p65的激活,进而下调Bcl-2蛋白的表达,并上调Bax蛋白的表达水平,使Bcl-2/Bax值下降;而Bcl-2的低表达又可通过诱导线粒体途径和受体途径,使胱天蛋白酶3的表达升高,从而诱发细胞凋亡。
由于PI3K/AKT通路和NF-κB通路与肿瘤细胞的增殖也密切相关,Akt和NF-κB-p65的激活被抑制,可影响肿瘤细胞的增殖能力[22,23,24],这与本文的研究结果相符。本文利用CCK-8和细胞克隆形成实验发现,相比10 μmol/L PLX4032对细胞的作用,10 μmol/L PLX4032联合0.5 μmol/L吴茱萸碱,能够显着地抑制A375/R细胞的克隆形成。
综上所述,吴茱萸碱能有效逆转黑色素瘤细胞对于PLX4032的耐药,其逆转作用与抑制Akt、NF-κB-p65的激活有关。而吴茱萸碱对于黑色素瘤的具体作用机制及其靶点,有待我们进一步的深入研究。
参考文献
[1] Schadendorf D, van Akkooi ACJ, Berking C, et al. Melanoma[J]. Lancet, 2018, 392(10151): 971-984
[2] Torres-Collado AX, Knott J, Jazirehi AR, et al. Reversal of Resistance in Targeted Therapy of Metastatic Melanoma: Lessons Learned from Vemurafenib(BRAFV600E-Specific Inhibitor)[J]. Cancers(Basel), 2018, 10(6): 157-175
[3] Li-Weber M. Targeting apoptosis pathways in cancer by Chinese medicine[J]. Cancer Lett, 2013, 332(2): 304-312
[4] Hu X, Li D, Chu C, et al. Antiproliferative Effects of Alkaloid Evodiamine and Its Derivatives[J]. Int J Mol Sci, 2018, 19(11):pii:E 3403
[5] Li YL, Pan YN, Wu WJ, et al. Evodiamine induces apoptosis and enhances apoptotic effects of erlotinib in wild-type EGFR NSCLC cells via S6K1-mediated Mcl-1 inhibition[J]. Med Oncol, 2016, 33(2): 16
[6] Guo XX, Li XP, Zhou P, et al. Evodiamine Induces Apoptosis in SMMC-7721 and HepG2 Cells by Suppressing NOD1 Signal Pathway[J]. Int J Mol Sci, 2018, 19(11).pii:E 3419
[7] Zhou P, Li XP, Jiang R, et al. Evodiamine inhibits migration and invasion by Sirt1-mediated post- translational modulations in colorectal cancer[J]. Anticancer Drugs, 2019, 30(6): 611-617
[8] Sui H, Zhou LH, Zhang YL, et al. Evodiamine Suppresses ABCG2 Mediated Drug Resistance by Inhibiting p50/p65 NF-κB Pathway in Colorectal Cancer[J]. J Cell Biochem 2016, 117(6): 1471-1481
[9] Khan M, Bi Y, Qazi JI, et al. Evodiamine sensitizes U87 glioblastoma cells to TRAIL via the death receptor pathway[J]. Mol Med Rep, 2015, 11(1): 257-262
[10] Kugel CH 3rd, Aplin AE. Adaptive resistance to RAF inhibitors in melanoma[J]. Pigment Cell Melanoma Res, 2014, 27(6): 1032-1038
[11] Welsh SJ, Rizos H, Scolyer RA, et al. Resistance to combination BRAF and MEK inhibition in metastatic melanoma: Where to next? [J]. Eur J Cancer, 2016, 62: 76-85
[12] Ribas A, Flaherty KT. BRAF targeted therapy changes the treatment paradigm in melanoma[J]. Nat Rev Clin Oncol, 2011, 8(7): 426-433
[13] Menzies AM, Long GV. Systemic treatment for BRAF-mutant melanoma: where do we go next?[J]. Lancet Oncol, 2014, 15(9): e371-e381
[14] Yang H, Higgins B, Kolinsky K, et al. RG7204(PLX4032), a selective BRAFV600E inhibitor, displays potent antitumor activity in preclinical melanoma models[J]. Cancer Res, 2010, 70(13): 5518-5527
[15] Chapman PB, Hauschild A, Robert C, et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation [J]. N Engl J Med, 2011, 364(26): 2507-2516
[16] Wei L, Jin X, Cao Z, et al. Evodiamine induces extrinsic and intrinsic apoptosis of ovarian cancer cells via the mitogen-activated protein kinase/phosphatidylinositol-3-kinase/protein kinase B signaling pathways[J]. J Traditl Chin Med, 2016, 36(3): 353-359
[17] Bai X, Meng H, Ma L, et al. Inhibitory effects of evodiamine on human osteosarcoma cell proliferation and apoptosis[J]. Oncol Lett, 2015, 9(2): 801-805
[18] Mohammad RM, Muqbil I, Lowe L, et al. Broad targeting of resistance to apoptosis in cancer[J]. Semin Cancer Biol, 2015, 35 Suppl: S78-S103
[19] 刘奔, 王帅, 林涛,等. Bcl-2过表达对多柔比星诱导的膀胱癌细胞凋亡和NF-κB活化影响的观察[J]. 中华肿瘤防治杂志(Liu B, Wang S, Lin T, et al . Effect of overexpression of Bcl-2 on doxorubicin- induced apoptosis and NF- kappa B activation in bladder cancer cells[J]. Chin J Cancer Prev Contr), 2009, 16(11): 841-844
[20] Hassan M, Watari H, AbuAlmaaty A, et al. Apoptosis and molecular targeting therapy in cancer[J]. Biomed Res Int, 2014, 2014: 150845
[21] Fulda S. Targeting apoptosis for anticancer therapy[J]. Semin Cancer Biol, 2015, 31: 84-88
[22] 尤金强, 王平. p53、bcl-2和bax基因蛋白表达与眼眶泪腺腺样囊性癌的关系[J].中华医学杂志(You J Q, Wang P. Relationship between p53, Bcl- 2 and bax gene protein expression and orbital lacrimal gland adenoid cystic carcinoma[J]. Natl Med J China), 2008, 88(28): 1978-1982
[23] Knowlton K, Mancini M, Creason S, et al. Bcl-2 slows in vitro breast cancer growth despite its anti-apoptotic effect[J]. J Surg Res, 1998, 76: 22-26
[24] Zhang J, Tong W, Sun H, et al. Nrf2-mediated neuroprotection by MANF against 6-OHDA-induced cell damage via PI3K/AKT/GSK3β pathway[J]. Exp Gerontol, 2017, 100: 77-86

